题目内容
9.在汽车尾气的排放出加装“催化净化器”,可将尾气中的NO、CO转化为无毒无害的混合气体,该气体是( )| A. | CO2、NH3(氨气) | B. | O2、CO2 | C. | N2、CO2 | D. | NO2、CO2 |
分析 根据质量守恒定律,化学反应前后各原子的种类和数目不变,反应前各原子的数目之和等于反应后各原子的数目之和,反应物为NO、CO,则产物也由氮、碳、氧三种元素组成.
解答 解:由质量守恒定律知,反应物为NO、CO,则产物也由氮、碳、氧三种元素组成,排除A、B;由题意知,尾气的转化产物为无毒无害的混合气体,D项中NO2有毒,
故选C.
点评 本题考查汽车尾气处理的产物,可根据质量守恒定律解答,也可根据日常生活经验解答.

练习册系列答案
相关题目
7.对下列实验中出现的异常情况的原因分析,不合理的是( )
| A. | 点燃氢气时发生爆炸--点燃前没有检验纯度 | |
| B. | 高锰酸钾制氧气并用排水法收集时,水槽中的水变红--试管口没有略向下倾斜 | |
| C. | 做细铁丝在氧气中燃烧实验时,铁丝没有燃烧--氧气纯度不够 | |
| D. | 制取CO2时,始终收集不到气体--装置气密性不好 |
8.下列化学方程式正确的是( )
| A. | C+2O$\frac{\underline{\;点燃\;}}{\;}$ CO2 | B. | 4Fe+3O2 $\frac{\underline{\;点燃\;}}{\;}$ 2Fe2O3 | ||
| C. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2+O2 | D. | 4P+5O2 $\frac{\underline{\;点燃\;}}{\;}$ 2P2O5 |
4.下列关于空气的说法中,错误的是( )
| A. | 空气是一种十分重要的天然资源 | |
| B. | 少量有害气体进入空气中,依靠大自然的自净能力,空气仍能保持洁净 | |
| C. | 空气中可吸入颗粒物的多少不影响人体健康 | |
| D. | 空气中的稀有气体一般不跟其他物质反应,曾被称为“惰性气体” |
14.下列情况处理不当的是( )
| A. | 酒精洒在桌上燃烧时,立即用湿抹布扑盖 | |
| B. | 可以用嘴吹灭酒精灯 | |
| C. | 进入实验室要注意按照要求做实验 | |
| D. | 实验用剩的药品放入指定容器内 |
1.下列物质的主要成份的化学式和名称不相符合的是( )
| A. | 食盐(NaCL) | B. | 氮气(N2) | C. | 氧化铁(Fe3O4) | D. | 氧化铝(Al2O3) |
19.科学家设想利用太阳能加热器“捕捉CO2”、“释放CO2”,实现碳循环.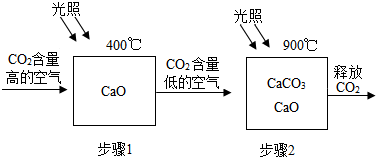
(1)步骤1的化学方程式为CaO+CO2$\frac{\underline{\;400℃\;}}{\;}$CaCO3.
(2)为确定步骤2中的碳酸钙是否完全分解,设计的实验方案如表所示:
(3)上述设想的优点有ab.(填字母序号)
a.原料易得且可循环利用 b.充分利用太阳能 c.可全地域全天候使用
(4)CO2是宝贵的碳氧资源.CO2和H2在一定条件下可合成甲酸(HCOOH),写出此反应的化学方程式CO2+H2$\frac{\underline{\;一定条件\;}}{\;}$HCOOH.

(1)步骤1的化学方程式为CaO+CO2$\frac{\underline{\;400℃\;}}{\;}$CaCO3.
(2)为确定步骤2中的碳酸钙是否完全分解,设计的实验方案如表所示:
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量固体于试管中,滴加过量稀盐酸溶液. | 试管内有气泡产生. | 分解不完全 |
a.原料易得且可循环利用 b.充分利用太阳能 c.可全地域全天候使用
(4)CO2是宝贵的碳氧资源.CO2和H2在一定条件下可合成甲酸(HCOOH),写出此反应的化学方程式CO2+H2$\frac{\underline{\;一定条件\;}}{\;}$HCOOH.