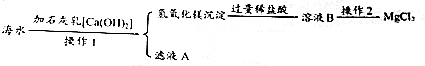题目内容
10.金属钛被称为铁和铝之后崛起的“第三金属”,钛的硬度大、熔点高、常温下耐酸碱、耐腐蚀,是航海、化工、医疗上不可缺少的材料.钛铁矿(主要成分FeTiO3)是工业上冶炼金属钛的主要原料,制备金属钛的一种工艺流程如图所示(部分产物略).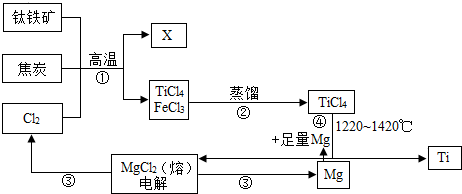
(1)X为可燃性氧化物,步骤①反应的化学方程式为2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$6CO+2TiCl4+2FeCl3.
(2)步骤②分离出TiCl4的方法,是利用了TiCl4与FeCl3的沸点不同.
(3)步骤④的化学方程式为TlCl4+2Mg$\frac{\underline{\;高温\;}}{\;}$2MgCl2+Ti,该反应说明Mg与Ti的金属活动性强弱关系为:Ti< Mg(填“<”、“>”或“=”).
(4)用上述冶炼方法得到的金属钛中会混有少量金属镁,由金属钛的性质可知,除去这种杂质可以用稀盐酸(填试剂名称).
(5)上述工艺具有成本低、可以用低品位的矿物为原料等优点,但依据绿色低碳理念,你认为该流程中存在的不足之处是耗能太高.
分析 (1)根据题中的反应物、生成物以及反应条件下书写化学方程式;
(2)根据步骤②通过蒸馏分离出TiCl4的方法,是利用了TiCl4与FeCl3的沸点不同进行分析;
(3)根据四氯化钛和镁在高温的条件下反应生成氯化镁和钛进行分析;
(4)根据镁会与酸反应,钛不会与酸反应进行分析;
(5)根据绿色化学的反应理念进行分析.
解答 解:(1)钛铁矿、碳和盐酸在高温的条件下反应生成一氧化碳、四氯化钛和氯化铁,化学方程式为:2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$6CO+2TiCl4+2FeCl3;
(2)步骤②通过蒸馏分离出TiCl4的方法,是利用了TiCl4与FeCl3的沸点不同;
(3)四氯化钛和镁在高温的条件下反应生成氯化镁和钛,化学方程式为:TlCl4+2Mg$\frac{\underline{\;高温\;}}{\;}$2MgCl2+Ti,该反应说明Mg与Ti的金属活动性强弱关系为:Ti<Mg;
(4)镁会与酸反应,钛不会与酸反应,所以除去钛杂质可以用稀盐酸;
(5)绿色化学的反应理念是原子利用率100%,没有有害物质生成,所以该流程中存在的不足之处是耗能太高.
故答案为:(1)2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$6CO+2TiCl4+2FeCl3;
(2)沸点;
(3)TlCl4+2Mg$\frac{\underline{\;高温\;}}{\;}$2MgCl2+Ti,<;
(4)稀盐酸;
(5)耗能太高.
点评 在解此类题时,首先分析题中所给的反应流程,然后结合学过的知识和题中的问题进行解答.

练习册系列答案
相关题目
20.金属钠能在纯净的CO2气体中燃烧,瓶内壁有黑色固体,瓶底有白色固体.下列结论肯定错误的是( )
| A. | 黑色固体是碳,白色固体是Na2CO3 | B. | 黑色固体是碳,白色固体是Na2O | ||
| C. | 黑色固体是CuO,白色固体是NaOH | D. | CO2气体不能扑灭任何火灾 |
1.新装修房室内存在甲醛(CH2O)、苯(C6H6)等有害物质.下列叙述正确的是( )
| A. | 甲醛分子中含有水分子 | |
| B. | 甲醛和苯都属于无机化合物 | |
| C. | 苯中碳元素与氢元素的质量比为1:1 | |
| D. | 甲醛中碳元素质量分数为40% |
18.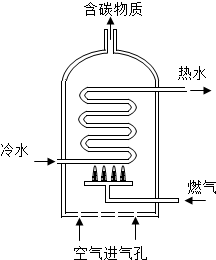 如图是燃气热水器示意图.
如图是燃气热水器示意图.
(1)某热水器以天然气为燃气.
①写出天然气完全燃烧的化学方程式CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.
②当“空气进气孔”被部分堵塞,燃烧将产生有毒
气体 M,M的化学式为CO.
(2)1kg不同燃料燃烧产生CO2和SO2的质量如表所示.
其中较清洁的燃料是天然气.使用煤作燃料时最易形成酸雨.
 如图是燃气热水器示意图.
如图是燃气热水器示意图.(1)某热水器以天然气为燃气.
①写出天然气完全燃烧的化学方程式CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.
②当“空气进气孔”被部分堵塞,燃烧将产生有毒
气体 M,M的化学式为CO.
(2)1kg不同燃料燃烧产生CO2和SO2的质量如表所示.
| 燃料 | 燃烧产物质最/S | |
| C〇2 | S〇2 | |
| 汽油 | 2900 | 5.0 |
| 天然气 | 2500 | 0.1 |
| 煤 | 2500 | 11.0 |
5.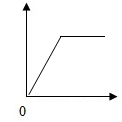 下列各选项与右图所示曲线相符的是( )
下列各选项与右图所示曲线相符的是( )
 下列各选项与右图所示曲线相符的是( )
下列各选项与右图所示曲线相符的是( )| 选项 | 横坐标 | 纵坐标 |
| A | 向一定量稀硫酸中加入锌粉的质量 | 溶液中氢元素的质量 |
| B | 向一定量的氢氧化钠和碳酸钠混合溶液中加入稀盐酸的质量 | 产生气体的质量 |
| C | 向一定量的澄清石灰水中加入碳酸钠溶液的质量 | 生成沉淀的质量 |
| D | 在一定温度下,向一定量的不饱和硝酸钾溶液中加入硝酸钾固体的质量 | 溶液中溶质的质量分数 |
| A. | A | B. | B | C. | C | D. | D |
2.芯片是电脑、智能家电的核心部件,它是以高纯度的单质硅(Si)为材料制成的.硅及其氧化物能发生如下反应:
①Si+O2$\frac{\underline{\;\;△\;\;}}{\;}$SiO2 ②SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑
③SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ ④Si+2NaOH+H2O═Na2SiO3+2H2↑
下列说法不正确的是( )
①Si+O2$\frac{\underline{\;\;△\;\;}}{\;}$SiO2 ②SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑
③SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ ④Si+2NaOH+H2O═Na2SiO3+2H2↑
下列说法不正确的是( )
| A. | ③属于置换反应 | |
| B. | 上述反应中生成了三种可燃性气体 | |
| C. | 硅不属于金属材料 | |
| D. | Si和SiO2在一定条件下可以相互转化 |
19. 实验小组探究盐酸和氢氧化钠反应过程中溶液 pH 的变化规律,得到如图所示曲线.下列 有关该实验事实的说法正确的是( )
实验小组探究盐酸和氢氧化钠反应过程中溶液 pH 的变化规律,得到如图所示曲线.下列 有关该实验事实的说法正确的是( )
 实验小组探究盐酸和氢氧化钠反应过程中溶液 pH 的变化规律,得到如图所示曲线.下列 有关该实验事实的说法正确的是( )
实验小组探究盐酸和氢氧化钠反应过程中溶液 pH 的变化规律,得到如图所示曲线.下列 有关该实验事实的说法正确的是( )| A. | 该实验是将氢氧化钠溶液滴入盐酸中 | |
| B. | B 点表示盐酸和氢氧化钠恰好完全反应 | |
| C. | C 点时的溶液能使酚酞试液变红 | |
| D. | A 点时,溶液中的溶质有氯化钠和氢氧化钠 |
 食醋、白酒、纯碱、白糖等均为厨房用品.从中选择适当物质,进行实践活动.
食醋、白酒、纯碱、白糖等均为厨房用品.从中选择适当物质,进行实践活动.