题目内容
向20g锌样品(杂质不溶于水,也不溶于酸)中加入100g质量分数为19.6%的稀硫酸,恰好完全反应。试计算该锌样品中锌的质量分数(写出计算过程)。
【答案】设20g锌样品中含有锌的质量为x ················· 1分
Zn + H2SO4 == ZnSO4 + H2↑ ·················· 1分
65 98
x 100g×19.6%
 =
= ·················· 2分
·················· 2分
x =13g ·················· 1分
锌样品中锌的质量分数= ×100%=65% ················ 1分
×100%=65% ················ 1分
答: 锌样品中锌的质量分数为65%。
【解析】根据质量守恒定律,由化学方程式中某一反应物的质量求另一反应物的质量。求样品中某一元素的质量分数,用该元素的质量与样品质量相比。

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
 、镁的质量比为1:1
、镁的质量比为1:1 含量,取10g水垢样品,向样品中加入足量的稀盐酸,其变化关系如下图所示,试计算:
含量,取10g水垢样品,向样品中加入足量的稀盐酸,其变化关系如下图所示,试计算:


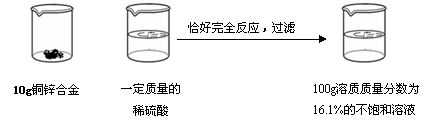
 .1%)
.1%)
