题目内容
5.某实验小组探究一定质量的锌(过量)和盐酸反应快慢的影响因素.采用控制变量法进行实验,具体实验数据如下表:| 实验序号 | 盐酸溶液用量及浓度 | 反应开始时盐酸溶液的温度 | 反应开始到2分钟产生氢气的体积 | 反应结束共产生氢气的体积 |
| ① | VmL、5% | 20℃ | 10mL | 60mL |
| ② | VmL、10% | 20℃ | 19mL | 118mL |
| ③ | VmL、15% | 20℃ | 28mL | 175mL |
| ④ | VmL、a% | 35℃ | 72mL | 118mL |
(2)10g 15%的盐酸溶液,能配制10%盐酸溶液的质量为15g,配制所需的玻璃仪器有烧杯、量筒、玻璃棒和胶头滴管.
(3)进行上表中的试验时,还应取用相同颗粒大小的锌.
(4)分析上表数据,得出影响该反应快慢的实验结论是反应物浓度越高,反应速度越快.
(5)为探究温度对该反应快慢的影响,实验④中盐酸溶液浓度a%应是10%.
分析 (1)根据反应物、生成物、反应条件,和化学方程式的书写步骤正确书写化学方程式.
(2)根据溶液稀释前后溶质的质量不变分析;根据配制溶质质量分数一定的溶液的步骤,分析解答;
(3)根据对照实验的唯一性分析;
(4)根据表中实验数据分析;
(5)根据对照实验的唯一性分析.
解答 解:(1)锌与盐酸反应生成氯化锌和氢气,反应的化学方程式为:Zn+2HCl═ZnCl2+H2↑;
(2)设能配制10%盐酸溶液的质量为x,
10g×15%=x×10%
x=15g,
配制溶质质量分数一定的溶液的步骤,首先计算配制溶液所需溶质和水的质量,再称量所需的溶质和量取水,最后进行溶解;在这些操作中需要的仪器:托盘天平、药匙、量筒、胶头滴管、烧杯和玻璃棒,其中属于玻璃仪器的是玻璃棒、烧杯、胶头滴管、量筒,由于本题用溶液配制溶液不需要称量,不需要托盘天平、药匙.
(3)实验中要保证锌粒的颗粒大小相同;
(4)实验数据可知其他条件相同时,反应物浓度越高,反应速度越快.
(5)为探究温度对该反应快慢的影响,所以实验的唯一变量为温度,由于②④反应结束共产生氢气的体积相同,应为实验②④形成对照,④中盐酸溶液浓度a%应是10%.
故答案为:(1)Zn+2HCl═ZnCl2+H2↑;(2)15g;量筒;(3)相同颗粒大小;(4)反应物浓度越高,反应速度越快;(5)10%.
点评 本题以影响产生氢气的反应速率为实验探究的形式考查了反应物浓度、颗粒的大小、反应温度等因素对化学反应速率的影响,重点在于培养学生的实验探究能力,注意控制变量的运用.

练习册系列答案
相关题目
9. 如图所示五个圆圈代表五种物质分别是单质、氧化物、酸、碱、盐中的某一种,它们之间的反应关系如图所示,图中两圆相交部分(a、b、c、d)表示物质间反应的有关现象及反应类型.下列说法中正确的是( )
如图所示五个圆圈代表五种物质分别是单质、氧化物、酸、碱、盐中的某一种,它们之间的反应关系如图所示,图中两圆相交部分(a、b、c、d)表示物质间反应的有关现象及反应类型.下列说法中正确的是( )
 如图所示五个圆圈代表五种物质分别是单质、氧化物、酸、碱、盐中的某一种,它们之间的反应关系如图所示,图中两圆相交部分(a、b、c、d)表示物质间反应的有关现象及反应类型.下列说法中正确的是( )
如图所示五个圆圈代表五种物质分别是单质、氧化物、酸、碱、盐中的某一种,它们之间的反应关系如图所示,图中两圆相交部分(a、b、c、d)表示物质间反应的有关现象及反应类型.下列说法中正确的是( )| A. | X可能是AgCl | B. | b处发生的反应后溶液呈黄色 | ||
| C. | c处可能生成白色沉淀 | D. | d处一定有白色沉淀生成 |
10. 小徐设计了一个探究硫酸铜溶液能否导电的实验,先用适量的蒸馏水将硫酸铜晶体完全溶解在广口瓶中,然后连接装置(如图所示),最后观察小灯泡能否发光.下面是同学们对该实验的讨论,其中不正确的是( )
小徐设计了一个探究硫酸铜溶液能否导电的实验,先用适量的蒸馏水将硫酸铜晶体完全溶解在广口瓶中,然后连接装置(如图所示),最后观察小灯泡能否发光.下面是同学们对该实验的讨论,其中不正确的是( )
 小徐设计了一个探究硫酸铜溶液能否导电的实验,先用适量的蒸馏水将硫酸铜晶体完全溶解在广口瓶中,然后连接装置(如图所示),最后观察小灯泡能否发光.下面是同学们对该实验的讨论,其中不正确的是( )
小徐设计了一个探究硫酸铜溶液能否导电的实验,先用适量的蒸馏水将硫酸铜晶体完全溶解在广口瓶中,然后连接装置(如图所示),最后观察小灯泡能否发光.下面是同学们对该实验的讨论,其中不正确的是( )| A. | 应分别补做硫酸铜晶体、蒸馏水能否导电的实验 | |
| B. | 硫酸铜溶液能导电的原因是溶液中有自由移动的离子 | |
| C. | 在电路中串联一个电流表可以增强该实验的可靠性 | |
| D. | 该实验设计合理,步骤正确、完整 |
17.生产和生活中的安全问题不可忽视,下列做法不正确的是( )
| A. | 进入煤矿时不用火把照明,可用矿井专用手电筒照明 | |
| B. | 烧碱不慎粘在皮肤上,立即用大量水冲洗后涂上硼酸溶液 | |
| C. | 浓硫酸不慎溅到皮肤上.立即用大量水冲洗后涂上小苏打溶液 | |
| D. | 发现房间内的天然气泄漏时.立即打开排风扇通风换气 |
14.甲、乙、丙三位同学分别做A和B反应生成C的化合反应实验.充分反应时,每个人所用A、B的质量各不相同,但总质量均为9克,有关数据见表,请填写表中的空格.
| 甲 | 乙 | 丙 | |
| m A/g | 2 | 4 | 6 |
| m B/g | 7 | 5 | 3 |
| m C/g | 3 | 6 | 9 |
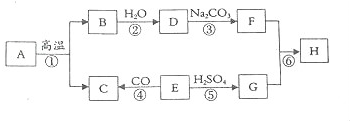
 A-G7种物质之间的转化关系如图所示,且B、C、G在常温下是气体,D是液体,E、F是有机物,F的相对分子质量是E的3倍.A的相对分子质量是79.E中的4种元素的原子个数比为1:1:2:4
A-G7种物质之间的转化关系如图所示,且B、C、G在常温下是气体,D是液体,E、F是有机物,F的相对分子质量是E的3倍.A的相对分子质量是79.E中的4种元素的原子个数比为1:1:2:4