题目内容
13.A-H是初中化学常见的物质,其中E为黑色固体,H为蓝色沉淀,这些物质的相互转化关系如图所示,其中部分生成物和反应条件已省略.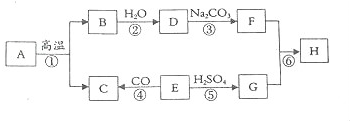
(1)写出下列物质的化学式:ACaCO3;ECuO.
(2)上述反应中属于分解反应的是反应①.(填序号)
(3)写出反应③的化学方程式:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
(4)写出反应⑥的化学方程式:CuSO4+2NaOH═Cu(OH)2↓+Na2SO4.
分析 以蓝色沉淀为氢氧化铜而猜测物质G为硫酸铜、物质F为氢氧化钠作为推断的突破口,根据转化关系图进行逆推,完成所涉及物质及反应的判断;根据判断结果,完成相关问题的解答.
解答 解:若物质G为能与氢氧化钠反应生成蓝色氢氧化铜沉淀的硫酸铜,而物质E既可与硫酸反应生成硫酸铜又能与一氧化碳反应,可判断E物质为黑色的氧化铜,而C是二氧化碳;B与水反应生成的D能与碳酸钠反应生成氢氧化钠,所以B是氧化钙,也就推出A的主要成分为碳酸钙,F物质为能与硫酸铜反应生成蓝色氢氧化铜沉淀的氢氧化钠,根据转化关系图,D与碳酸钠生成F物质氢氧化钠,则物质D应为氢氧化钙;带入框图,推断合理;
(1)A是碳酸钙,E是氧化铜,故填:CaCO3;CuO;
(2)A高温分解生成B和C,属于分解反应,故填:①;
(3)反应③是氢氧化钙与碳酸钠反应生成碳酸钙沉淀和 氢氧化钠,故填:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(4)反应⑥是氢氧化钠与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,故填:CuSO4+2NaOH═Cu(OH)2↓+Na2SO4.
点评 根据常见物质的颜色作为推断类问题的突破口,是解决转化关系推断问题的一种常用方法,因此对于常见物质颜色的掌握则是很重要的.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.中和一定质量的氢氧化钠,需要a%的盐酸m g,若改用a%的稀硫酸中和,恰好完全中和时需要稀硫酸的质量( )
| A. | 大于m g | B. | 小于m g | C. | 等于m g | D. | 无法比较 |
5.某实验小组探究一定质量的锌(过量)和盐酸反应快慢的影响因素.采用控制变量法进行实验,具体实验数据如下表:
(1)锌与盐酸反应的化学方程式为Zn+2HCl═ZnCl2+H2↑.
(2)10g 15%的盐酸溶液,能配制10%盐酸溶液的质量为15g,配制所需的玻璃仪器有烧杯、量筒、玻璃棒和胶头滴管.
(3)进行上表中的试验时,还应取用相同颗粒大小的锌.
(4)分析上表数据,得出影响该反应快慢的实验结论是反应物浓度越高,反应速度越快.
(5)为探究温度对该反应快慢的影响,实验④中盐酸溶液浓度a%应是10%.
| 实验序号 | 盐酸溶液用量及浓度 | 反应开始时盐酸溶液的温度 | 反应开始到2分钟产生氢气的体积 | 反应结束共产生氢气的体积 |
| ① | VmL、5% | 20℃ | 10mL | 60mL |
| ② | VmL、10% | 20℃ | 19mL | 118mL |
| ③ | VmL、15% | 20℃ | 28mL | 175mL |
| ④ | VmL、a% | 35℃ | 72mL | 118mL |
(2)10g 15%的盐酸溶液,能配制10%盐酸溶液的质量为15g,配制所需的玻璃仪器有烧杯、量筒、玻璃棒和胶头滴管.
(3)进行上表中的试验时,还应取用相同颗粒大小的锌.
(4)分析上表数据,得出影响该反应快慢的实验结论是反应物浓度越高,反应速度越快.
(5)为探究温度对该反应快慢的影响,实验④中盐酸溶液浓度a%应是10%.
2.KNO3是一种常见的复合肥,其在一定温度下的溶解度如下表所示,下列说法正确的是( )
| 温度/℃ | 0 | 10 | 20 | 30 | 40 |
| KNO3(溶解度/g) | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 |
| A. | KNO3饱和溶液中不能再溶解任何物质 | |
| B. | 40℃时100g的KNO3饱和溶液含KNO3的质量为63.9g | |
| C. | 30℃时,KNO3溶液的溶质质量分数为45.8% | |
| D. | 20℃时的KNO3饱和溶液降温至0℃,有晶体析出 |
3.某黄铜矿的主要成分为CuFeS2.经测定,其中硫的质量分数为a%,则该矿中铁的质量分数为( )
| A. | $\frac{7a}{8}$% | B. | 2a% | C. | 32% | D. | 无法确定 |
 某补钙药剂的标签主要内容如图所示,现测定该钙片含量是否符合标注,做如下实验:取10片该钙片,放入干燥、洁净的烧杯中,再向烧杯中加入50g某浓度稀盐酸,恰好完全反应(钙片中其他成分不溶于水,也不和稀
某补钙药剂的标签主要内容如图所示,现测定该钙片含量是否符合标注,做如下实验:取10片该钙片,放入干燥、洁净的烧杯中,再向烧杯中加入50g某浓度稀盐酸,恰好完全反应(钙片中其他成分不溶于水,也不和稀