题目内容
11.用过氧化氢制取并收集氧气时,一定不需要的仪器有( )| A. | 酒精灯 | B. | 长颈漏斗 | C. | 集气瓶 | D. | 水槽 |
分析 用过氧化氢制取氧气,属于固液常温型,结合收集氧气可用排水法或向上排空气法,进行分析判断.
解答 解:A、用过氧化氢制取氧气,属于固液常温型,无需使用酒精灯,故选项正确.
B、用过氧化氢制取氧气,属于固液常温型,可使用长颈漏斗,故选项错误.
C、用过氧化氢制取氧气,收集气体需使用集气瓶,故选项错误.
D、用过氧化氢制取氧气,用排水法收集氧气需使用水槽,故选项错误.
故选:A.
点评 本题难度不大,是中考的重要考点之一,熟练掌握实验室中制取氧气的反应原理、发生装置和收集装置的选择依据等是正确解答本题的关键.

练习册系列答案
相关题目
1.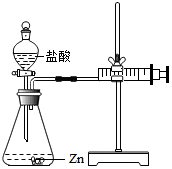 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
【提出问题】金属与盐酸反应的剧烈程度受哪些因素的影响?
【作出猜想】a.可能与金属本身的性质有关;
b.可能与盐酸的浓度有关.
【设计探究】实验所用金属均已用砂纸打磨
实验(1):为探究猜想a,小组同学分别在两支试管中放入相同质量的镁片和铁片,然后分别加入相同浓度和质量的稀盐酸,观察到放镁片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,写出镁与稀盐酸发生反应的化学方程式Mg+2HCl=MgCl2+H2↑;从实验现象可判断:金属活动性Mg>Fe(填“<”“=”或“>”);
得出结论:金属与盐酸发生反应的剧烈程度与金属本身的性质有关,金属的活动性与反应的剧烈程度的关系是金属与盐酸反应的剧烈程度与金属本身性质有关(金属活动性越强,反应越剧烈).
实验(2):为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是通过注射器往右移动的体积判断生成氢气的体积所用药品、实验数据如表:
得出结论:金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是其他条件相同时,盐酸浓度越大,反应越剧烈.
【反思评价】
(注意:若答对本小题将奖励4分,但化学试卷总分不超过60分)
根据表中实验II数据分析,请描述锌与盐酸发生反应快慢的变化情况并解释原因由慢到快然后逐渐减慢;锌与稀盐酸反应放热,随着反应的进行,温度升高,所以速度越来越快,一段时间后,盐酸被消耗,盐酸浓度变小,反应速率减慢.通过以上探究,你认为金属与盐酸反应的剧烈程度可能还受哪些因素的影响①温度;②金属表面积大小.(答两条即可)
 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.【提出问题】金属与盐酸反应的剧烈程度受哪些因素的影响?
【作出猜想】a.可能与金属本身的性质有关;
b.可能与盐酸的浓度有关.
【设计探究】实验所用金属均已用砂纸打磨
实验(1):为探究猜想a,小组同学分别在两支试管中放入相同质量的镁片和铁片,然后分别加入相同浓度和质量的稀盐酸,观察到放镁片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,写出镁与稀盐酸发生反应的化学方程式Mg+2HCl=MgCl2+H2↑;从实验现象可判断:金属活动性Mg>Fe(填“<”“=”或“>”);
得出结论:金属与盐酸发生反应的剧烈程度与金属本身的性质有关,金属的活动性与反应的剧烈程度的关系是金属与盐酸反应的剧烈程度与金属本身性质有关(金属活动性越强,反应越剧烈).
实验(2):为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是通过注射器往右移动的体积判断生成氢气的体积所用药品、实验数据如表:
| 实验 编号 | 选用金属 (均取2g) | 盐酸浓度 (均取50 mL) | 每30秒产生气体的体积/mL | |||||
| 30秒 | 30~ 60秒 | 60~ 90秒 | 90~ 120秒 | 120~ 150秒 | 前150秒收 集气体 | |||
| Ⅰ | 锌片 | 10% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 48.5 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
【反思评价】
(注意:若答对本小题将奖励4分,但化学试卷总分不超过60分)
根据表中实验II数据分析,请描述锌与盐酸发生反应快慢的变化情况并解释原因由慢到快然后逐渐减慢;锌与稀盐酸反应放热,随着反应的进行,温度升高,所以速度越来越快,一段时间后,盐酸被消耗,盐酸浓度变小,反应速率减慢.通过以上探究,你认为金属与盐酸反应的剧烈程度可能还受哪些因素的影响①温度;②金属表面积大小.(答两条即可)
16.下列说法中正确的是( )
| A. | 人体中含量最多的金属元素是铁元素 | |
| B. | 在化学反应中只有燃烧才能放热 | |
| C. | 将石油分馏可以得到多种产品 | |
| D. | 合金的各种性能都比纯金属好 |
3.如图中实验操作正确的是( )
| A. |  | B. |  | C. |  | D. |  |
 在如图转化关系中,生成物D能使带星的木条复燃,F是一种常见的液体,H能使澄清石灰水变浑浊,在反应②中,B的质量和化学性质均没有改变.
在如图转化关系中,生成物D能使带星的木条复燃,F是一种常见的液体,H能使澄清石灰水变浑浊,在反应②中,B的质量和化学性质均没有改变. A、B、C是三种常见的含钙化合物,它们之间有如图所示的转化关系(部分产物略去):
A、B、C是三种常见的含钙化合物,它们之间有如图所示的转化关系(部分产物略去):