题目内容
12. 某厂排放的废水中含有硫酸铜,将废水处理可得到铜和铁红(氧化铁)两种产品,过程如图所示(废水中的其他物质不参与反应):
某厂排放的废水中含有硫酸铜,将废水处理可得到铜和铁红(氧化铁)两种产品,过程如图所示(废水中的其他物质不参与反应):(1)过程①和过程②充分反应后都需进行的操作是过滤.
(2)写出过程①和过程②中发生反应的化学方程式:
①Fe+CuSO4═FeSO4+Cu;②Fe+H2SO4=FeSO4+H2↑.
分析 从废液中含有硫酸铜,到产品中有铜(Cu)和氧化铁两种产品,找到废液中成分与产品之间的关系入手,在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.
解答 解:由于题目中指出:“处理可得到铜和铁红(氧化铁)两种产品”,根据质量守恒定律可知,要想制取铜,就要把硫酸铜中的铜置换出,而题目中又明确指出铁红(氧化铁)两种产品,符合题意的物质A金属为铁.铁则可以和硫酸铜溶液反应,生成硫酸亚铁和铜,由于要将全部铜离子置换出来,需要加入过量的A(铁);由于加入是过量铁,由铁有剩余,故固体C的成分为剩余的铁和生成的铜;要获得产品铜就要除去剩余的铁,由于在金属活动顺序表中铁位于氢之前而铜位于氢之后,铁可和稀硫酸反应,而铜不反应,故可在固体C中加入适量的稀硫酸,由此确定产品F为铜,溶液B和溶液E均为硫酸亚铁溶液,另一种产品G则只能是氧化铁.
(1)过程①和过程②充分反应后都需得到了固体和溶液,故操作是分离不溶性固体和液体的方法,为过滤操作,故填:过滤;
(2)过程①中物质A是过量的铁,加入A发生的化学方程式为:Fe+CuSO4═FeSO4+Cu.过程②中物质D是适量的硫酸,发生反应的化学方程式Fe+H2SO4=FeSO4+H2↑.故答案为:Fe+CuSO4═FeSO4+Cu;Fe+H2SO4=FeSO4+H2↑.
点评 注意不要让题目中的无关信息所干扰,静下心来,运用所学知识,排除干扰,找到题目答案.

练习册系列答案
相关题目
2.化学兴趣小组的同学复习元素及其化合物知识以后,互相交流自己的学习体会,下面是四位同学的发言,你认为其中正确的是( )
| A. | 浓盐酸、浓硫酸都能使纸张炭化 | |
| B. | CO、H2、O2、CH4均可作为燃料 | |
| C. | 烧碱溶液和石灰水都具有腐蚀性 | |
| D. | SO2、CO2、CO都可用氢氧化钠溶液吸收 |
3.下列四组溶液,仅用组内物质就能鉴别出来且均为无色溶液的是( )
| A. | HCl FeCl3 KOH ZnSO4 | B. | NH4NO3 Ba(OH)2 H2SO4 MgCl2 | ||
| C. | NaCl MgCl2 K2SO4 CuSO4 | D. | K2CO3 Na2SO4 BaCl2 NaOH |
1.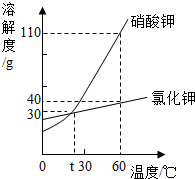 如图是硝酸钾和氣化钾的溶解度曲线,下列说法正确的是( )
如图是硝酸钾和氣化钾的溶解度曲线,下列说法正确的是( )
 如图是硝酸钾和氣化钾的溶解度曲线,下列说法正确的是( )
如图是硝酸钾和氣化钾的溶解度曲线,下列说法正确的是( )| A. | 硝酸钾的溶解度一定大于氯化钾的溶解度 | |
| B. | t℃时,硝酸钾溶液的浓度一定等于氯化钾溶液的浓度 | |
| C. | 把60℃时硝酸钾溶液降温至30℃,一定有硝酸钾晶体析出 | |
| D. | 60℃时,把50 g上述物质分别加入到50 g水中,充分溶解得到硝酸钾溶液的质量一定大于氯化钾溶液的质量 |
 实验室利用下图装置测量久置于空气中NaOH样品的纯度.取2g样品与足量稀盐酸反应,产生气体在量程范围内,气体的密度为1.95g/L) 请回答下列问题.
实验室利用下图装置测量久置于空气中NaOH样品的纯度.取2g样品与足量稀盐酸反应,产生气体在量程范围内,气体的密度为1.95g/L) 请回答下列问题. 能源和环境问题日益成为人们关注的焦点.
能源和环境问题日益成为人们关注的焦点.