题目内容
9.学习了CO2的有关知识后,同学们查阅资料发现Mg能在CO2中燃烧:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,所以镁着火不能用CO2来灭火,但没有找到有关Na能否与CO2反应的介绍.于是同学们展开了钠着火能否用CO2来灭火的探究.【提出猜想】钠能发生类似于CO2与镁的反应,可能的化学方程为4Na+CO2$\frac{\underline{\;点燃\;}}{\;}$2Na2O+C.
【实验】将燃着的钠伸入装有CO2的集气瓶中,钠能在集气瓶中继续燃烧.进一步
【查阅资料】得知:
①Na2O是白色固体,能与CO2反应生成Na2CO3,与H2O反应生成NaOH.
②Na2CO3的存在会干扰NaOH的检测.
基于以上资料,同学们认为钠在CO2中燃烧的产物情况有所不同,并对产物提出了以下几种猜想:
①Na2O、C;②Na2CO3、C;③NaOH、C;④Na2O、Na2CO3、C
通过理论分析,猜想③(填序号)肯定错误的,理由是NaOH中有氢元素而反应物中没有氢元素,根据质量守恒定律可知③错误.
【验证猜想】
步骤 实验操作 主要实验现象 结论(燃烧产物判断)
(1)将产物溶于适量水中 部分溶解,试管底部有黑色固体 燃烧产物中肯定有C
(2)取少量(1)所得上层溶液,加入过量的CaCl2溶液,产生现象为有白色沉淀生成,则燃烧产物中肯定有Na2CO3
(3)取少量(2)所得上层清液,加入CuSO4(或CuCl2),溶液变红,则燃烧产物中肯定有Na2O
【交流讨论】在步骤(2)中CaCl2溶液为什么要加入至过量?其原是:完全除去Na2CO3,以免Na2CO3干扰NaOH的检验.
【结论】猜想④(填序号)是正确的.
分析 【提出猜想】钠能发生类似于CO2与镁的反应,用类比的方法可书写其发生的化学方程式;
【实验】根据资料,同学们认为钠在CO2中燃烧的产物应该与Mg在CO2中燃烧的产物情况有所不同,并对产物提出几种猜想;通过质量守恒定律可知分析,猜想③肯定是错误的;
【验证猜想】
由操作和现象,得出结论;或由操作和结论,推测现象;或由现象和结论,推测操作.了解在步骤(2)中CaCl2溶液为什么要加入至过量的原因.
【结论】由猜想得结论.
解答 解:【提出猜想】钠能发生类似于CO2与镁的反应,故可用类比的方法书写其发生的化学方程式为:4Na+CO2$\frac{\underline{\;点燃\;}}{\;}$2Na2O+C.
【实验】将燃着的钠伸入装有CO2的集气瓶中,钠能在CO2中继续燃烧.
进一步查阅资料得知:①Na2O是白色固体,能与CO2反应生成Na2CO3,与H2O反应生成NaOH.②Ca(OH)2溶于水而CaCO3不溶于水.③Na2CO3的存在会干扰NaOH的检测.基于以上资料,同学们认为钠在CO2中燃烧的产物应该与Mg在CO2中燃烧的产物情况有所不同,并对产物提出了以下几种猜想:①Na2O、C;②Na2CO3、C;③NaOH、C;④Na2O、Na2CO3、C;
通过理论分析,猜想:③肯定是错误的,理由是:NaOH中有氢元素而反应物中没有氢元素,根据质量守恒定律可知③错误.
【验证猜想】由操作和现象,得出结论;或由操作和结论,推测现象;或由现象和结论,推测操作:
(2)取少量(1)所得上层溶液,加入过量的CaCl2溶液,产生现象为有白色沉淀生成,则燃烧产物中肯定有Na2CO3
(3)取少量(2)所得上层清液,加入CuSO4(或CuCl2),溶液变红,则燃烧产物中肯定有Na2O;
【交流讨论】在步骤(2)中CaCl2溶液为什么要加入至过量?其原是:完全除去Na2CO3,以免Na2CO3干扰NaOH的检验.
【结论】猜想④是正确的.
在步骤(2)中CaCl2溶液要加入至过量,目的是完全除去Na2CO3,以免Na2CO3干扰NaOH的检验.
【结论】通过实验验证可知猜想Ⅳ正确.
故答案为:【提出猜想】4Na+CO2$\frac{\underline{\;点燃\;}}{\;}$2Na2O+C;
【实验】Na2CO3;③;NaOH中有氢元素而反应物中没有氢元素,根据质量守恒定律可知③错误;
【验证猜想】
(2)有白色沉淀生成;
(3)CuSO4(或CuCl2);Na2O;
【交流讨论】完全除去Na2CO3,以免Na2CO3干扰NaOH的检验;
【结论】④.
点评 掌握质量守恒定律的也是守恒的思想处理问题;了解物质的鉴别与推断的方法.

 53随堂测系列答案
53随堂测系列答案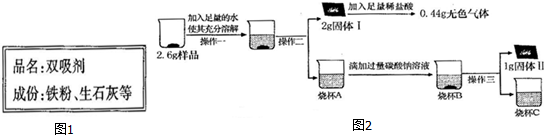
【提出问题】久置“双吸剂”固体的成分是什么?
【查阅资料】
①铁与氯化铁溶液在常温下反应生成氯化亚铁
:Fe+2FeCl3═3FeCl2;
②碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应.
【作出猜想】久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3.
【实验探究1】下表是小明设计的实验方案和记录的实验报告,请你补充完整.
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量样品放入试管中,滴加一定量的稀盐酸.用带异營的单孔橡皮塞塞紧试管口,导管另 一端伸入澄清石灰水中. | 试管中固体逐漸减少,有大量无色气体产生,得到浅绿色溶液,澄清石灰水变浑浊. | 样品中一定含有Fe和CaCO3, 不含Fe2O3. |
| (2)取少量样品放入试管中,加水 溶解,静置后取上层清液滴加无 色酚酞试液. | 试管底部有不溶物,上层清液由无色变为红色. | 样品中含有氧化钙或氢氧化钙. |
为进一步确定这包久置的“双吸剂”固体的成分进行如下定量实验.
【实验探究2】取3g样品研碎,并用磁铁充分吸引后,得到剩余固体2.6g,按照图2流程进行实验,请回答相关问题:
(1)操作二、操作三名称是过滤.
(2)固体I的成分是CaCO3和Fe2O3.(填物质化学式,下同);
(3)烧杯A中溶液和加入的碳酸钠溶液反应的化学方程式为Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
| A. | 单质:硅、水银、金刚石 | |
| B. | 碱:氢氧化钡、氢氧化钠、生石灰 | |
| C. | 酸:硝酸、盐酸、硫酸 | |
| D. | 氧化物:氧化镁、三氧化硫、五氧化二磷 |
| A. | FeSO4 | B. | FeSO4、ZnSO4 | C. | Fe2(S04)3、ZnS04 | D. | FeSO4、CuSO4 |
| A. | 测定空气中O2含量:点燃红磷后缓慢伸入集气瓶并基紧瓶塞,导致测定结果偏低 | |
| B. | 制取气体时装置的气密性不好:收集的气体不纯净 | |
| C. | 取用稀硫酸:取出一部分溶液后,溶液的浓度偏低 | |
| D. | 用天平称量固体药品时,将药品和砝码放反了,称量结果不一定存在误差 |
| A. |  | B. |  | C. |  | D. |  |

