题目内容
15.粗盐中含有少量不溶性杂质(泥沙),还含有少理可溶性杂质(Na2SO4、CaCl2、MgCl2).某校化学兴趣小组以实验室现有的试剂,蒸馏水、BaCl2、NaOH溶液、稀盐酸、Na2 CO3溶液、Ba(NO3)2溶液和必要的仪器,将粗盐提纯,实验过程如图所示
(1)操作a、b、c都要用到一种玻璃仪器玻璃棒,其中操作b的名称过滤.
(2)I中加入X溶液是BaCl2(填化学式),II中除去的离子是Mg2+(用符号表示),III加入过量Y溶液的目的是除尽溶液的离子Ba2+、Ca2+(用符号表示).
(3)加入适量稀盐酸的作用是除去溶液中的Na2CO3、NaOH(填化学式).
(4)在加热蒸发过程中,要用玻璃棒不断地搅拌,其目的是防止受热不均,造成液滴飞溅.
分析 (1)根据实验流程可知,操作a是溶解,操作b是过滤,操作c是蒸发,都用到的一种玻璃仪器是玻璃棒,操作b将不溶性固体从溶液中分离,所以操作b是过滤进行分析;
(2)根据加入氢氧化钠克将氯化镁转化成氢氧化镁沉淀,除去硫酸钠需要在除去氯化钙之前,加入的碳酸钠可以将过量的氯化钡除去,所以I中加入X溶液是BaCl2溶液,II中除去的离子是Mg2+,III加入过量Y溶液的目的是除尽溶液的离子Ba2+、Ca2+,进行分析;
(3)根据加入的除杂试剂氢氧化钠和碳酸钠都是过量的,所以在蒸发之前想,需要加入盐酸将碳酸钠和氢氧化钠除去进行分析;
(4)根据在加热蒸发过程中,要用玻璃棒不断地搅拌,其目的是防止受热不均,造成液滴飞溅进行分析.
解答 解:(1)通过分析实验流程可知,操作a是溶解,操作b是过滤,操作c是蒸发,都用到的一种玻璃仪器是玻璃棒,操作b将不溶性固体从溶液中分离,所以操作b是过滤;
(2)加入氢氧化钠克将氯化镁转化成氢氧化镁沉淀,除去硫酸钠需要在除去氯化钙之前,加入的碳酸钠可以将过量的氯化钡除去,所以I中加入X溶液是BaCl2溶液,II中除去的离子是Mg2+,III加入过量Y溶液的目的是除尽溶液的离子Ba2+、Ca2+;
(3)加入的除杂试剂氢氧化钠和碳酸钠都是过量的,所以在蒸发之前想,需要加入盐酸将碳酸钠和氢氧化钠除去;
(4)在加热蒸发过程中,要用玻璃棒不断地搅拌,其目的是防止受热不均,造成液滴飞溅.
故答案为:(1)玻璃棒,过滤;
(2)BaCl2,Mg2+,Ba2+、Ca2+;
(3)Na2CO3、NaOH;
(4)防止受热不均,造成液滴飞溅.
点评 本题考查了粗盐提纯的相关问题,很好的考查了学生根据所学知识分析和解决问题的能力,尤其是除杂知识的应用.

练习册系列答案
相关题目
5.下列物质的用途中,主要利用其化学性质的是( )
| A. | 铜丝做导线 | B. | 石墨制铅笔芯 | C. | 液氨做制冷剂 | D. | 焦炭用于炼铁 |
6. 溶解度是解决溶液相关问题的重要依据.
溶解度是解决溶液相关问题的重要依据.
I.根据图1解决下列问题:(M,N均不含结晶水)
(1)溶解度随温度的升高而减小的是N,温度为t2℃时,M,N两种物质的溶解度相等;
(2)t1℃时,将20gM加入50g水中,充分溶解,形成溶液的质量为65g.保持温度不变,向该溶液中再加入10g水充分搅拌,溶液的溶质质量分数将不变(填“变大”、“变小”或“不变”);
Ⅱ.根据表格解决实际问题:
某KNO3样品中含有少量K2CO3,其提纯过程如图2:

(1)操作2的名称是过滤.若图2中溶液B是饱和溶液,则C是饱和(填“饱和”或“不饱和”)溶液;
(2)写出向溶液A中加入Cu(NO3)2发生反应的化学方程式K2CO3+Ca(NO3)2=CaCO3↓+2KNO3 .
 溶解度是解决溶液相关问题的重要依据.
溶解度是解决溶液相关问题的重要依据.I.根据图1解决下列问题:(M,N均不含结晶水)
(1)溶解度随温度的升高而减小的是N,温度为t2℃时,M,N两种物质的溶解度相等;
(2)t1℃时,将20gM加入50g水中,充分溶解,形成溶液的质量为65g.保持温度不变,向该溶液中再加入10g水充分搅拌,溶液的溶质质量分数将不变(填“变大”、“变小”或“不变”);
Ⅱ.根据表格解决实际问题:
| 温度/℃ | 20 | 30 | 50 | 60 | 80 | |
| 溶解度/g | KNO3 | 31.6 | 45.8 | 85.5 | 100 | 169 |
| K2CO3 | 110 | 114 | 121 | 126 | 139 | |

(1)操作2的名称是过滤.若图2中溶液B是饱和溶液,则C是饱和(填“饱和”或“不饱和”)溶液;
(2)写出向溶液A中加入Cu(NO3)2发生反应的化学方程式K2CO3+Ca(NO3)2=CaCO3↓+2KNO3 .
10.根据表中的数据,回答下列问题.
(1)20℃时,称取31.6gKNO3固体加入盛有100g水的烧杯中,充分溶解形成的溶液是饱和(填“饱和”或“不饱和”)溶液;称取31.6g KNO3固体时,发现托盘天平指针偏右,接下来的操作是继续加KNO3固体至天平平衡.
(2)当KNO3中混有少量NaCl时,提纯KNO3所采用的方法为降温结晶(或冷却热饱和溶液).
(3)将等质量KNO3的饱和溶液和NaCl的饱和溶液从60℃降温到20℃时,对所得溶液的叙述正确的是(填序号)A、C(填序号).
A、都是饱和溶液 B、溶剂质量:KNO3>NaCl C、溶液质量:KNO3<NaCl.
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/ | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
(2)当KNO3中混有少量NaCl时,提纯KNO3所采用的方法为降温结晶(或冷却热饱和溶液).
(3)将等质量KNO3的饱和溶液和NaCl的饱和溶液从60℃降温到20℃时,对所得溶液的叙述正确的是(填序号)A、C(填序号).
A、都是饱和溶液 B、溶剂质量:KNO3>NaCl C、溶液质量:KNO3<NaCl.
4.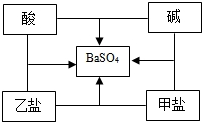 小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质可实现如图中所示的 所有反应.若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )
小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质可实现如图中所示的 所有反应.若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )
 小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质可实现如图中所示的 所有反应.若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )
小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质可实现如图中所示的 所有反应.若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )| A. | HCl NaOH BaCl2 Na2SO4 | B. | H2SO4 Ba(OH)2 Na2SO4 BaCl2 | ||
| C. | HCl Ba(OH)2 Na2SO4 BaCl2 | D. | H2SO4 NaOH BaCl2 Na2SO4 |
5.下列各组物质用稀硫酸不能完全区分开的是( )
| A. | 镁粉、氧化铜粉末、木炭粉 | B. | 铁片、铝片、银片 | ||
| C. | Na2CO3溶液、NaCl溶液、BaCl2溶液 | D. | NaOH溶液、Ba(OH)2溶液、KOH溶液 |
 实验室有如图所示装置,回答下列问题:
实验室有如图所示装置,回答下列问题: