题目内容
17.下列有关叙述中,正确的是( )| A. | KClO3中Cl的化合价为+6价 | B. | NH3中N的化合价为-3价 | ||
| C. | CO2中C的化合价为+2价 | D. | H2O、H2O2中O的化合价都是-2价 |
分析 根据在化合物中正负化合价代数和为零,结合化学式进行解答本题.
解答 解:在化合物中正负化合价代数和为零.
A、钾元素显+1价,氧元素显-2价,设氯元素的化合价是x,可得:(+1)+x+(-2)×3=0,则x=+5价.
B、氢显+1价,NH3中N的化合价为-3价.
C、氧显-2价,CO2中C的化合价为+4价.
D、氢显+1价,H2O、H2O2中O的化合价分别是-2、-1价.
故选:B.
点评 本题难度不大,掌握利用化合价的原则(化合物中正负化合价代数和为零)计算指定元素的化合价的方法即可正确解答本题.

练习册系列答案
相关题目
7. 如表是硝酸钾(KNO3)和氯化钾(KCl)在不同温度时的溶解度,请回答下列问题:
如表是硝酸钾(KNO3)和氯化钾(KCl)在不同温度时的溶解度,请回答下列问题:
(1)由表可查知,40℃时氯化钾(KCl)的溶解度为40克,它的意义是在40℃时,氯化钾在100g水里达到饱和时溶解的质量是40g.
(2)40℃时,向两个分别盛有45g KNO3和KCl固体的烧杯中,各加入100g的水,充分溶解后,结果如图所示,则乙烧杯中的溶质是KNO3.
(3)采用任意一种操作方法,将甲烧杯中的剩余固体全部溶解,并将溶液变为不饱和溶液.下列说法中正确的是ACD(填字母).
A.溶剂质量可能不变 B.溶液中溶质的质量分数一定增大
C.溶液质量一定增大 D.可采用升温或加水的方法
(4)若要配得溶质质量分数为40%以上的硝酸钾(KNO3)溶液,配制时的温度应不低于50℃
 如表是硝酸钾(KNO3)和氯化钾(KCl)在不同温度时的溶解度,请回答下列问题:
如表是硝酸钾(KNO3)和氯化钾(KCl)在不同温度时的溶解度,请回答下列问题:| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
| 溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
| KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | |
(2)40℃时,向两个分别盛有45g KNO3和KCl固体的烧杯中,各加入100g的水,充分溶解后,结果如图所示,则乙烧杯中的溶质是KNO3.
(3)采用任意一种操作方法,将甲烧杯中的剩余固体全部溶解,并将溶液变为不饱和溶液.下列说法中正确的是ACD(填字母).
A.溶剂质量可能不变 B.溶液中溶质的质量分数一定增大
C.溶液质量一定增大 D.可采用升温或加水的方法
(4)若要配得溶质质量分数为40%以上的硝酸钾(KNO3)溶液,配制时的温度应不低于50℃
5.下列无色透明溶液,能大量共存的是( )
| A. | K+、Na+、HCO3-、OH- | B. | Cl-、MnO4-、K+、Na+ | ||
| C. | SO42-、K+、Cl-、NO3- | D. | H+、NO3-、CO32-、Fe2+ |
12.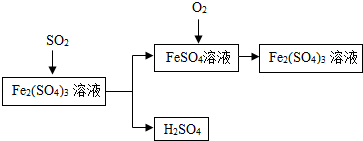 含硫煤燃烧会产生SO2造成大气污染,某工厂设计了如下工艺流程,防治污染的同时可以得到化工产品,下列叙述不正确的是( )
含硫煤燃烧会产生SO2造成大气污染,某工厂设计了如下工艺流程,防治污染的同时可以得到化工产品,下列叙述不正确的是( )
 含硫煤燃烧会产生SO2造成大气污染,某工厂设计了如下工艺流程,防治污染的同时可以得到化工产品,下列叙述不正确的是( )
含硫煤燃烧会产生SO2造成大气污染,某工厂设计了如下工艺流程,防治污染的同时可以得到化工产品,下列叙述不正确的是( )| A. | 该流程中可得到化工产品H2SO4 | |
| B. | 该流程中化合价发生改变的元素为Fe和S | |
| C. | 流程中涉及到的反应之一为:Fe(SO4)3+SO2+2H2O=2FeSO4+2H2SO4 | |
| D. | 该工艺流程中Fe2(SO4)3溶液可以循环使用 |
6.铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:
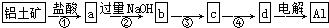
下列说法中错误的是( )
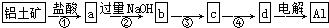
下列说法中错误的是( )
| A. | ①②中除加试剂外,还需要进行过滤操作 | |
| B. | a、b中铝元素的化合价相同 | |
| C. | ③中需要通入过量的氨气 | |
| D. | ④进行的操作是加热,而且d一定是氧化铝 |