题目内容
16.换铁矿的主要成份是FeS2.请回答:(1)FeS2相对分子质量为120.
(2)FeS2中铁、硫的原子数比为1:2.
(3)FeS2中铁元素的质量分数为46.7%.
分析 根据相对分子质量=相对原子质量与相应原子个数的乘积和;
根据分子是由原子构成的解答;
根据某元素质量分数=$\frac{相对原子质量×原子个数}{相对分子质量}$×100%解答.
解答 解:(1)相对分子质量=相对原子质量与相应原子个数的乘积和,则FeS2相对分子质量=56+32×2=120;
(2)FeS2中铁、硫的原子个数比为:Fe:S=1:2;
(3)FeS2中铁元素的质量分数=$\frac{56}{120}$×100%≈46.7%.
故答案为:
120;1:2;46.7%
点评 主要考查了相对分子质量的计算方法,元素质量分数的求法以及利用相对质量求物质中所含元素的比值的方法,这些基本计算要求掌握.

练习册系列答案
相关题目
16.柠檬酸(其化学式为C6H8O7)是一种重要的有机酸,它在工业、食品业、化妆业等具有极多的用途.下列有关柠檬酸的说法中错误的是( )
| A. | 柠檬酸是由碳、氢、氧三种元素组成的 | |
| B. | 柠檬酸的相对分子质量为192 | |
| C. | 一个柠檬酸分子中含有6个碳原子、8个氢原子和7个氧原子 | |
| D. | 柠檬酸中,碳、氢、氧三种元素的质量比为6:8:7 |
6.下列属于合金的是( )
| A. | 生铁 | B. | 铁矿石 | C. | 四氧化三铁 | D. | 铁丝 |
 科学家最近在低温下合成了一种化合物,其分子模型如图所示,其中“
科学家最近在低温下合成了一种化合物,其分子模型如图所示,其中“ ”代表碳原子,“
”代表碳原子,“ ”代表氢原子.
”代表氢原子.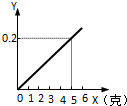 某不纯的铁粉与稀硫酸反应时,质量关系如图所示,x表示不纯铁粉消耗的质量,Y表示生成氢气的质量,试判断不纯铁粉中混入的杂质是( )
某不纯的铁粉与稀硫酸反应时,质量关系如图所示,x表示不纯铁粉消耗的质量,Y表示生成氢气的质量,试判断不纯铁粉中混入的杂质是( ) 城市生活垃圾的处理是世界性难题.如图是某垃圾处理厂对生活垃圾进行处理与综合利用的部分工艺流程.
城市生活垃圾的处理是世界性难题.如图是某垃圾处理厂对生活垃圾进行处理与综合利用的部分工艺流程.
