题目内容
19.目前,人们使用的燃料大多来自化石燃料,如煤、石油和天然气等,它们都是不可再生能源.(1)天然气的主要成分是什么?
(2)写出煤燃烧产生的一种有害物质;
(3)化石能源有限,我们将面临着能源危机,所以目前亟待解决的问题是开发新能源,写出一种你知道的新能源.
分析 (1)天然气的主要成分是甲烷;
(2)煤燃烧时能生成二氧化碳、一氧化碳、二氧化硫、烟尘等物质;
(3)积极开发利用新能源,不但能够节约化石燃料,还能够减缓环境污染.
解答 解:(1)天然气的主要成分是甲烷;
(2)煤燃烧产生的有害物质有一氧化碳、二氧化硫、烟尘等;
(3)人类正在开发利用的新能源有太阳能、核能、风能、水能、地热能、潮汐能、氢能等.
答案:
(1)甲烷;
(2)一氧化碳、二氧化硫、烟尘等;
(3)太阳能、核能、风能、水能、地热能、潮汐能、氢能等.
点评 化石燃料日趋枯竭,开发利用新能源对于缓解当前的能源危机具有重要意义.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
6.春暖花开季节,人们站在紫丁香树旁,常闻到怡人的香味.这一现象说明( )
| A. | 分子很大 | B. | 分子分裂成原子 | ||
| C. | 分子在不停地运动 | D. | 分子之间有空隙 |
7.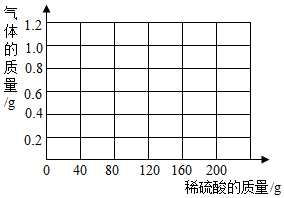 镁带在空气中放置一段时间表面会氧化,其中所含的其它杂质与稀硫酸不反应.为了测定某种镁带中镁的质量分数,某实验小组进行如下实验:先用细砂纸打磨镁带表面,使用精密天平称取打磨后11.25克镁带样品放在烧杯中,每次加入40.00克稀硫酸(不考虑水的挥发)使充分反应,测量反应前后装置连同内盛物质的质量.
镁带在空气中放置一段时间表面会氧化,其中所含的其它杂质与稀硫酸不反应.为了测定某种镁带中镁的质量分数,某实验小组进行如下实验:先用细砂纸打磨镁带表面,使用精密天平称取打磨后11.25克镁带样品放在烧杯中,每次加入40.00克稀硫酸(不考虑水的挥发)使充分反应,测量反应前后装置连同内盛物质的质量.
记录实验数据如表:
根据以上实验数据通过计算求:
(1)稀硫酸中溶质的质量分数.
(2)镁带样品中镁的质量分数.
(3)在坐标纸上绘出产生的气体质量与所加硫酸质量的关系曲线.
 镁带在空气中放置一段时间表面会氧化,其中所含的其它杂质与稀硫酸不反应.为了测定某种镁带中镁的质量分数,某实验小组进行如下实验:先用细砂纸打磨镁带表面,使用精密天平称取打磨后11.25克镁带样品放在烧杯中,每次加入40.00克稀硫酸(不考虑水的挥发)使充分反应,测量反应前后装置连同内盛物质的质量.
镁带在空气中放置一段时间表面会氧化,其中所含的其它杂质与稀硫酸不反应.为了测定某种镁带中镁的质量分数,某实验小组进行如下实验:先用细砂纸打磨镁带表面,使用精密天平称取打磨后11.25克镁带样品放在烧杯中,每次加入40.00克稀硫酸(不考虑水的挥发)使充分反应,测量反应前后装置连同内盛物质的质量.记录实验数据如表:
| 加入稀硫酸次数 | 1 | 2 | 3 | 4 | 5 | 6 |
| 烧杯和所称物质总质量(克) | 120.15 | 159.95 | 199.75 | 239.55 | 279.45 | 319.45 |
(1)稀硫酸中溶质的质量分数.
(2)镁带样品中镁的质量分数.
(3)在坐标纸上绘出产生的气体质量与所加硫酸质量的关系曲线.
7.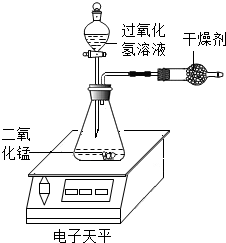 某化学兴趣小组对过氧化氢分解生成水和氧气的条件进行探究,请你参与.
某化学兴趣小组对过氧化氢分解生成水和氧气的条件进行探究,请你参与.
[提出问题]哪些因素可能影响该反应的反应速率?
[查阅资料]影响化学反应速率的因素:反应物本身的性质、温度、浓度、催化剂、光、反应物颗粒大小、反应物之间的接触面积和反应物的状态等.
[作出猜想]下面是三位同学所做的猜想,请你完成丙同学的猜想.
甲同学:H2O2溶液的浓度可能影响该反应的反应速率.
乙同学:催化剂(MnO2)的用量可能影响该反应的反应速率.
丙同学:温度可能影响该反应的反应速率.
[实验验证]
(1)如图实验装置,在常温下,每次均取10mL30%的H2O2溶液,然后稀释成不同浓度的溶液进行实验,测定各次电子天平示数减少0.2g所用的时间,记录数据如表:
请你分析回答:
①该反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
②要比较不同浓度的H2O2溶液对反应速率的影响,可选择的实验编号是3、4(写一组),由此可得到的结论是在在催化剂、温度等相同的条件下,H2O2溶液的浓度越大,反应越快.
③从上述实验中得出催化剂(MnO2)的用量对反应速率的影响是二氧化锰的用量越多,反应速率越快.达到一定的用量时,速率不在改变
④若撤除干燥管装置,所测速率偏大(选填“偏大”、“偏小”或“不变”).
如果你是丙同学,在验证你的猜想时,你的实验方案是:在MnO2的用量、H2O2溶液的浓度等相同的条件下,控制不同温度,记录收集相同体积的氧气时所用的时间.
[拓展延伸]
(3)如表是甲同学在实验时记录电子天平的示数和对应的时间的一组数据(每隔20s读数一次).
①上表数据分析得出,过氧化氢溶液分解速度的变化情况是逐渐变慢(选填“先快后慢”“先慢后快”“逐渐变慢”),原因是过氧化氢的浓度逐渐减小.
(4)通过该探究实验,你还想探究的问题或还想学习的知识是除MnO2外,是否还有其它物质可作此反应的催化剂.
 某化学兴趣小组对过氧化氢分解生成水和氧气的条件进行探究,请你参与.
某化学兴趣小组对过氧化氢分解生成水和氧气的条件进行探究,请你参与.[提出问题]哪些因素可能影响该反应的反应速率?
[查阅资料]影响化学反应速率的因素:反应物本身的性质、温度、浓度、催化剂、光、反应物颗粒大小、反应物之间的接触面积和反应物的状态等.
[作出猜想]下面是三位同学所做的猜想,请你完成丙同学的猜想.
甲同学:H2O2溶液的浓度可能影响该反应的反应速率.
乙同学:催化剂(MnO2)的用量可能影响该反应的反应速率.
丙同学:温度可能影响该反应的反应速率.
[实验验证]
(1)如图实验装置,在常温下,每次均取10mL30%的H2O2溶液,然后稀释成不同浓度的溶液进行实验,测定各次电子天平示数减少0.2g所用的时间,记录数据如表:
| 实验编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| H2O2溶液浓度 | 5% | 5% | 5% | 10% | 10% | 30% | 30% |
| MnO2粉末(g) | 1.0 | 0.8 | 0.6 | 0.6 | 0.4 | 0.4 | 0.2 |
| 所用的时间(s) | 205 | 205 | 220 | 80 | 90 | 3 | 4 |
①该反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
②要比较不同浓度的H2O2溶液对反应速率的影响,可选择的实验编号是3、4(写一组),由此可得到的结论是在在催化剂、温度等相同的条件下,H2O2溶液的浓度越大,反应越快.
③从上述实验中得出催化剂(MnO2)的用量对反应速率的影响是二氧化锰的用量越多,反应速率越快.达到一定的用量时,速率不在改变
④若撤除干燥管装置,所测速率偏大(选填“偏大”、“偏小”或“不变”).
如果你是丙同学,在验证你的猜想时,你的实验方案是:在MnO2的用量、H2O2溶液的浓度等相同的条件下,控制不同温度,记录收集相同体积的氧气时所用的时间.
[拓展延伸]
(3)如表是甲同学在实验时记录电子天平的示数和对应的时间的一组数据(每隔20s读数一次).
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 | 120 | 140 | 160 | 180 | 200 |
| 示数(g) | 565.40 | 565.37 | 565.34 | 565.30 | 565.28 | 565.26 | 565.24 | 565.23 | 565.22 | 565.21 | 565.20 |
(4)通过该探究实验,你还想探究的问题或还想学习的知识是除MnO2外,是否还有其它物质可作此反应的催化剂.

 A〜H 初中化学常见的物质,已知A为黑色固体单质,B为红色粉末,C和E常温下为气体且均属氧化物,F的浓溶液能挥发出剌激性气味的气体,G-H发生的是化合反应.它们的转化关系如图所示,请回答下列问题:
A〜H 初中化学常见的物质,已知A为黑色固体单质,B为红色粉末,C和E常温下为气体且均属氧化物,F的浓溶液能挥发出剌激性气味的气体,G-H发生的是化合反应.它们的转化关系如图所示,请回答下列问题:
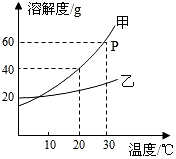 如图是甲、乙两种固体物质的溶解度曲线.据图回答:
如图是甲、乙两种固体物质的溶解度曲线.据图回答: