题目内容
同学们利用“硫酸、硝酸铵、氢氧化钠、碳酸钾”四种物质的溶液进行探究学习,完成下列各问:
【实验探究】
(1)A、B、C、D四组同学分别进行了下列实验

写出下列的两个化学方程式:
①A中的反应
②D中的反应
【挖掘实质】
右图是A组反应的微观过程示意图该化学反应的实质可以表示为 
 【实践运用】
【实践运用】
完成试验后,四组同学将废液倒入同一个烧杯中,再将废液过滤,得到无色溶液和白色沉淀,用无色溶液滴加紫色石蕊试剂,变为红色。
(2)①溶液中的白色沉淀一定是 ,理由是
(3)废液中一定不含有的离子是
(4)为了验证该 溶液中可能含有的离子是否存在,我设计如下实验进行验证:
溶液中可能含有的离子是否存在,我设计如下实验进行验证:
| 溶液中可能含有的离子 | 实验步骤 | 实验现象 | 实验结论 |
| ①可能含有 | ②取滤液滴加 | 现象明显 | 含有该离子 |
【答案】(1)①H2SO4 + 2NaOH ==== Na2SO4 + 2H2O ②K2CO3+Ba(NO3)2=BaCO3↓+2KNO3(2)①BaSO4 ②硫酸钡不溶于酸,碳酸钡能溶于酸 (3)OH-和CO (4)①SO
(4)①SO ②硝酸钡溶液(或①Ba2+ ②稀硫酸)
②硝酸钡溶液(或①Ba2+ ②稀硫酸)
【解析】A中是氢氧化钠和硫酸间的反应,生成硫酸钠和水,D中是硝酸钡和碳酸钾间反应,生成碳酸钡沉淀和硝酸钾,将四支试管中的液体混合后,滴加石蕊,溶液显红色说明溶液显酸性,即溶液中含有酸,根据四支试管中的反应,生成的沉淀是碳酸钡和硫酸钡中的一种或两种,但碳酸钡能溶于酸,硫酸钡不溶于 酸,所以溶液中有酸时,沉淀中就没有碳酸钡,即溶淀只是硫酸钡,四种物质中涉及的离子有氢离子、钾离子、钡离子、钠离子、硝酸根离子、硫酸根离子、氢氧根离子和碳酸根离子,由于混合后溶液显酸性,所以溶液中一定不存在氢氧根离子和碳酸根离子,由于钠盐、钾盐和硝酸盐都可溶,所以溶液中一定存在的离子是氢离子、钠离子、钾离子和硝酸根离子,可能存在的离子是硫酸根离子和钡离子中的一种,根据题意,探究中只利用四种物质,所以可利用硝酸钡溶液检验溶液中是否存在硫酸根离子,利用稀硫酸检验溶液中是否存在钡离子。
酸,所以溶液中有酸时,沉淀中就没有碳酸钡,即溶淀只是硫酸钡,四种物质中涉及的离子有氢离子、钾离子、钡离子、钠离子、硝酸根离子、硫酸根离子、氢氧根离子和碳酸根离子,由于混合后溶液显酸性,所以溶液中一定不存在氢氧根离子和碳酸根离子,由于钠盐、钾盐和硝酸盐都可溶,所以溶液中一定存在的离子是氢离子、钠离子、钾离子和硝酸根离子,可能存在的离子是硫酸根离子和钡离子中的一种,根据题意,探究中只利用四种物质,所以可利用硝酸钡溶液检验溶液中是否存在硫酸根离子,利用稀硫酸检验溶液中是否存在钡离子。

 名校课堂系列答案
名校课堂系列答案下列对一些事实的解释正确的是( )
| 序号 | 事实 | 解释 |
| A | 氧气用于金属切割 | 氧气具有可燃性 |
| B | 石墨用来制取金刚石 | 石墨中的碳原子可以重新排 |
| C | 墨汁写的字或作的画可永久保存 |
|
| D | 水电解产生氢气和氧气 | 化学变化中原子是可以再分的 |
在研究酸和碱的化学性质时,某小组想证明稀硫酸和氢氧化钠溶液混合后,虽然无明显现象,但确实发生了化学反应。试与他们一起完成实验方案的设计、实施和评价,并得出有关结论。
(1)探究稀硫酸和氢氧化钠溶液的反应:
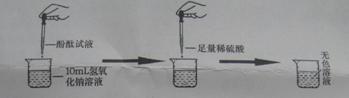 当滴入几滴酚酞试液后,溶液由无色变为 色。根据上述实验中颜色变化,可确定稀硫酸和氢氧化钠溶液发生了化学反应,反应的化学方程式为: ;
当滴入几滴酚酞试液后,溶液由无色变为 色。根据上述实验中颜色变化,可确定稀硫酸和氢氧化钠溶液发生了化学反应,反应的化学方程式为: ;
(2)探究上述稀硫酸和氢氧化钠溶液反应后烧杯中的硫酸是否过量:
根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量。同学们又分别选取氯化钡溶液、紫色石蕊试液设计实验方案,请你判断并分析:
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 稀硫酸过量 |
| 方案二 | 取样,滴入几滴紫色石蕊试液 | 溶液变红 | 稀硫酸过量 |
上述设计的实验方案中,正确的是 (填“方案一”或“方案二”);
另外一个实验方案错误的原因是 ;
若请你再设计一个确定稀硫酸是否过量的实验方案,你选用的药品是 ,实验现象及结论是 。
实验室有一瓶标签破损的无色溶液如图21,同学们对该溶液的成分进行了探究。
【提出问题】该溶液的成分是什么?
【猜想假设】①可能是CaCl2溶液;②你的猜想是 溶液;
【查阅资料】CaCl2的水溶液呈中性
【设计实验】同学们设计了如下实验方案并进行实验,请你完成实验报告.
| 实验操作 | 实验现象 | 实验结论 |
| 取该溶液少量于试管中, |
|
|
化学兴趣小组的同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,小组内小明同学认为有两种可能:
猜想1:该溶液没有变质 猜想2:该溶液全部变质
(1)小组同学讨论后认为还有一种可能,请你补充出猜想3: 。
(2)为了验证猜想3,小红同学设计了如下实验方案,请你帮他完成实验报告的填写
| 实验步骤 | 实验现象 | 结论 |
| 1.取样, ,过滤 | 产生白色沉淀 | 猜想3成立 |
| 2.向上述滤液中滴加几滴无色酚酞溶液 | 酚酞溶液变红 |
(3)探究启示:氢氧化钠必须 保存。
过氧化钠(Na2O2)可用作呼吸面具的供氧剂.实验室有一瓶放置较长时间的过氧化钠样品,某研究小组对其成分和性质进行了如下探究.
【查阅资料】1.过氧化钠能与空气中水和二氧化碳反应生成氧气:
2Na2 O2 +2H2 O=4NaOH+02↑,2Na202+2C02==2Na2CO3+O2.
【提出问题]1.过氧化钠是否变质?
【猜想与假设】
假设1:过氧化钠未变质;假设2:过氧化钠部分变质;假设3:过氧化钠全部变质.
【实验探究】
| 序号 | 实验步骤 | 实验现象 | 实验结论 |
| ① | 取部分固体于试管中,加人足量的水,在试管口播人带火星的木条; | 固体完全溶解, 木条复然 | 假设______ 不成立 |
| 取少量①中溶液于试管中,滴加足量的 ______,振荡. | 有气泡生成 | 假设2成立 |
【提出新问题】部分变质的过氧化钠中是否含有氢氧化钠?
【实验探究】取少量①中溶液于试管中,加人足量的氯化钙溶液,有白色沉淀生成,静置,向上层 清液中滴加2滴无色酚酞试液,溶液变红.
【定性分析】
(1)由实验③可以确定①中溶液含有的溶质是_______(填化学式);
(2)小明认为,由上述实验无法确定原固体样品中是否含有氢氧化钠,理由是_________。
【定量研究】称取6.04g的过氧化钠样品于锥形瓶中,加入足量的蒸馏水,共收集到气体0.64g,再向上述锥形瓶中加入足量的澄清石灰水,充分反应后,经过沉淀、过滤、干燥等,得到固体2.00g。
(1)写出加入澄清石灰水的反应方程式__________________________
(2)6.04g上述样品中,含氢氧化钠的质量_______________。
【反思与提高】过氧化钠长期暴露在空气中,最终会变质为_______(填化学式)
 列
列
 【反思与拓展】①若向NH4Cl的溶液中加一定量CaH2,充分反应,产生的气体是 _______;②登山运动员常用CaH2作为能源提供剂,与氢气相比,其优点是__________________。
【反思与拓展】①若向NH4Cl的溶液中加一定量CaH2,充分反应,产生的气体是 _______;②登山运动员常用CaH2作为能源提供剂,与氢气相比,其优点是__________________。

 )(填序号)。
)(填序号)。