题目内容
9.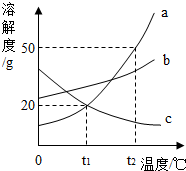 如图是a、b、c 三种固体物质的溶解度曲线.
如图是a、b、c 三种固体物质的溶解度曲线.(1)0℃时,a、b、c三种物质中,溶解度最大的是c.
(2)将t1℃时三种物质的饱和溶液升温至t2℃时,能观察到明显的现象是c中有固体析出.
(3)t2℃时,将65ga物质放入100g水中,充分搅拌,所得溶液的质量是150g.
(4)t1℃时,a、c两种物质饱和溶液的溶质质量分数为16.7%.(精确到0.1%)
分析 根据溶解度曲线的意义进行分析解答,在同一温度下,对应的溶解度曲线越高,则溶解度越大;饱和溶液是指在一定温度下在一定量的溶剂里不能再溶解某种溶质的溶液,据此解答.
解答 解:(1)据图可以看出,0℃时,a、b、c三种物质中,溶解度最大的是c,故填;c.
(2)c物质的溶解度随温度的升高而减小,故将t1℃时三种物质的饱和溶液升温至t2℃时,c会析出固体,能观察到明显的现象是c中有固体析出,故填:c中有固体析出.
(3)t2℃时,a物质的溶解度是50g,将65ga物质放入100g水中,只能溶解50g,充分搅拌,所得溶液的质量是50g+100g=150g,故填:150.
(4)t1℃时,a、c两种物质的溶解度为20g,饱和溶液的溶质质量分数为$\frac{20g}{100g+20g}×100%≈16.7%$,故填:16.7%.
点评 明确溶解度定义及曲线的含义是解答本题关键.

练习册系列答案
相关题目
20.构成物质的微粒有分子、原子和离子,有关这三种粒子的叙述错误的是( )
| A. | 只要构成两种物质的分子相同,则这两种物质的化学性质就相同 | |
| B. | 同种原子可能构成不同种分子 | |
| C. | 决定原子质量大小的主要是质子和电子 | |
| D. | 原子如果得到或失去电子就变成离子,其化学性质就发生了变化 |
17.将乙醇和氧气置于密闭容器中引燃,测得反应前后各物质的质量如下:
请回答下列问题:
(1)X在反应后待测数值为1.4g;
(2)请计算判断X的组成元素:含有两种元素,其质量之比为3:4;
(3)若X是CO,那么该反应的化学方程式为2C2H5OH+5O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+6H2O+2CO.
| 物质(纯净物) | 乙醇 | 氧气 | 二氧化碳 | 水 | X |
| 反应前质量/g | 2.3 | 4 | 0 | 0 | 0 |
| 反应后质量/g | 0 | 0 | 2.2 | 2.7 | 待测 |
(1)X在反应后待测数值为1.4g;
(2)请计算判断X的组成元素:含有两种元素,其质量之比为3:4;
(3)若X是CO,那么该反应的化学方程式为2C2H5OH+5O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+6H2O+2CO.
14.有A、B、C、D四种原子,已知它们的核电荷数依次增大且为四个连续的数.B和D的原子核里质子数和中子数相等,A和C的原子核里质子数比中子数少1,已知B原子核外有10个电子.
(1)根据以上事实填写如表:
(2)分析表中的数据,你发现了哪些规律?
①质子数=核电荷数=核外电子数
②质子数不一定等于中子数.
(1)根据以上事实填写如表:
| 原子种类 | 质子数 | 中子数 | 核外电子数 | 核电荷数 |
| A | ||||
| B | 10 | |||
| C | ||||
| D |
①质子数=核电荷数=核外电子数
②质子数不一定等于中子数.
 唐子杰同学通过学习“蜡烛及其燃烧的探究”,对蜡烛燃烧、酒精灯火焰、家庭使用的天然气燃烧等产生了兴趣,于是开始了系列实验.
唐子杰同学通过学习“蜡烛及其燃烧的探究”,对蜡烛燃烧、酒精灯火焰、家庭使用的天然气燃烧等产生了兴趣,于是开始了系列实验.