题目内容
4.实验室制取气体的装置如图1所示,根据所学的知识回答下列问题.
(1)写出装置中标号仪器的名称:①试管;②长颈漏斗.
(2)实验室用高锰酸钾制取氧气,可选用的发生装置是B(填字母).写出该反应的化学方程式:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(3)写出实验室用大理石和稀盐酸制取二氧化碳的化学方程式:CaCO3+2HCl═CaCl2+H2O+CO2↑
并据此选择上图中CDE(填字母)组装一套制取干燥二氧化碳的装置.
①小红同学想把制取二氧化碳结束后的废液未经处理直接倒入下水道,可能造成的危害是腐蚀铁质下水管道、污染水源等(写一条).
②小红取反应后的废液50g,逐滴加入质量分数为26.5%的碳酸钠溶液.他根据实验测得的数据绘出如图2,其中纵坐标m是实验得到的沉淀或气体的质量,横坐标表示的是碳酸钠溶液质量.下列说法正确的是C.
A.图中oa段表示生成的沉淀量
B.c点表示碳酸钠恰好完全反应
C.与50g废液恰好完全反应时消耗碳酸钠溶液的质量为30g
D.最终产生气体的质量为5g.
分析 (1)熟悉常见仪器,了解名称;
(2)根据药品的状态和反应所需的条件选择发生装置,高锰酸钾制取氧气时试管口要放一团棉花,并据反应原理书写方程式;
(3)根据实验室制取二氧化碳的药品的状态和反应条件选择发生装置,要得到干燥的二氧化碳可用浓硫酸干燥,再根据二氧化碳的密度比空气大,利用后向上排空法收集二氧化碳;
①根据废液中的成分分析直接倒入下水道,分析可能造成的危害;
②根据实验室制取二氧化碳的反应原理和图象可知,废液中有生成的氯化钙和剩余的盐酸,再根据图象特点来解答该题.
解答 解:(1)图中标号仪器分别是:①试管,②长颈漏斗;
(2)由于是加热固体制氧气,如选用高锰酸钾制取氧气时,应在试管口加一团棉花,所以,发生装置选择B;反应的方程式是:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(3)实验室用大理石和稀盐酸制取二氧化碳的化学方程式:CaCO3+2HCl═CaCl2+H2O+CO2↑,该反应属于固液常温型,所以应选择C装置做发生装置,二氧化碳密度比空气大、能溶于水,浓硫酸具有吸水性,可用来干燥气体,所以经过D装置干燥后,通过E装置收集;
①废液中常含有盐酸,直接倒入下水道,盐酸可与铁反应,所以可能造成的危害:腐蚀铁质下水管道、污染水源等;
②根据实验室制取二氧化碳的反应原理可知,废液中一定有氯化钙,又根据图象可知刚滴加碳酸钠溶液时,没有沉淀生成,说明废液中有剩余的盐酸;滴加碳酸钠溶液时,碳酸钠首先与盐酸反应,生成氢气,当加入10mL碳酸钠时,盐酸恰好完全反应,生成1.1g气体,线段oa表示生成的气体量;继续滴加碳酸钠与氯化钙生成沉淀,当加入30mL碳酸钠时废液恰好完全反应,生成5g碳酸钙沉淀.所以,C正确.
故答为:(1):①试管;②长颈漏斗;
(2)B;2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(3)CaCO3+2HCl═CaCl2+H2O+CO2↑;CDE;
①腐蚀铁质下水管道、污染水源等;②C.
点评 本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,验满,同时也考查了化学方程式的书写等,要理解和熟记碳酸钠与碳酸钙等相关知识,然后,根据所给的实验、问题情景或图表信息等,细致地图表信息,联系起来综合分析,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.

| A. | 为了获得感性认识,可触摸药品和品尝味道 | |
| B. | 滴管伸入试管可以准确地把液体滴入试管 | |
| C. | 选用50ml的量筒量取8ml液体 | |
| D. | 给试管内的液体加热时,试管口不能对着人 |
| A. | 婴幼儿生长发育不良,患佝偻病,可以适量补钙 | |
| B. | 水果蔬菜能给人体补充营养物质,可以只吃水果蔬菜不吃主食 | |
| C. | 庄稼生长不旺:叶色发黄、易倒伏,施用复合肥硝酸钾 | |
| D. | 固体燃料粉碎或把液体燃料喷成雾状,能使燃料更充分 |
| 甲 | 乙 | 丙 | |
| 所用氧气质量 | 2 | 4 | 6 |
| 产生二氧化硫质量 | 4 | 8 | m |
(2)以上甲、乙、丙的实验哪些符合质量守恒定律?
(3)以上哪次实验中硫和氧气恰好完全反应?
实验一:甲小组的同学收集到一包主要成分是小苏打(碳酸氢钠)的疏松剂
(1)取样品溶于适量的水中,测得溶液的pH大于7.
(2)向小苏打样品中滴加盐酸,有大量气泡产生,经检验该气体是二氧化碳.该反应的化学方程式为NaHCO3+HCl═NaCl+H2O+CO2↑.
(3)同学们通过查阅资料,在老师的指导下采用了图1所示装置用小苏打和纯碱做了对比实验.实验中小试管内沾有无水硫酸铜粉末的棉花球变成蓝色,a烧杯中石灰水无明显现象,b烧杯中石灰水出现白色浑浊.试回答:
①在实验结束时,操作上要注意的问题是:先将烧杯a、b中的导气管移出,再熄灭酒精灯.
②由实验(3)可以得出的结论是碳酸钠受热不分解,碳酸氢钠受热分解出水和CO2等物质.北方农村地区用“碱面”(碳酸钠)蒸馒头时,必须先将面粉发酵(产生一些有机酸)的原因是使碱面与酸反应生成CO2气体(碳酸钠受热不分解).
实验二:乙小组的同学收集到一包名为“臭粉”的疏松剂,为探究其组成,进行实验:
(1)“臭粉”为一种白色固体,易溶于水;
(2)取少量样品与稀盐酸混合后产生了可以使石灰水变混浊的气体;
(3)取少量样品加热后,产生了有刺激性气味的气体;
(4)少量样品与氢氧化钠溶液混合后共热,产生了使湿润的红色石蕊试纸变蓝的臭气.
调查后得知,“臭粉”的主要成分是初中化学课本中一种常见的盐.
①你认为该盐是NH4HCO3,它加热后反应的方程式为NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑.
②用“臭粉”作疏松剂的油炸食品放置后再销售和食用的原因可能是使煎炸产生的氨气挥发.
③某些小商贩喜欢选用“臭粉”代替“小苏打”作疏松剂的原因可能是等质量的碳酸氢铵生成气体的量比碳酸氢钠多.
实验三:丙小组同学探究小苏打、“臭粉”在制作食品过程中产生气泡的原因
(1)两种疏松剂产生的气体中都含有CO2.推测产生这种气体的原因有受热分解出二氧化碳;与酸反应产生二氧化碳.
(2)小组的同学将少许面粉加入水中取上层液体用pH试纸测得:pH=7.猜测产生气体的原因是受热分解出的二氧化碳.
实验四:丁小组的同学在某超市发现一种复合疏松剂--发酵粉,其成分见下表:
| 成分 | 所用物质 |
| 碳酸盐类 | 碳酸氢钠 |
| 酸性物质 | 柠檬酸、酒石酸等 |
| 疏松剂 | 明矾 |
| 其他成分 | 淀粉、脂肪酸等 |
(2)为测定其中碳酸氢钠的质量分数,小组的同学设计了如下实验,其主要实验步骤如下:

Ⅰ.按图2组装仪器,将50.0g试样放入锥形瓶中,加入足量某酸溶液;
Ⅱ.测量一定时间内干燥管内物质增加的质量(见图3曲线);
Ⅲ.待锥形瓶中不再产生气泡时,打开活塞B,从导管A处缓缓鼓入一定量的空气;
Ⅳ.再次称量干燥管内物质增加的质量;
Ⅴ.重复Ⅲ和Ⅳ的操作,直至干燥管内物质质量不变.
讨论:
①步骤Ⅰ.加入样品前还应检查装置的气密性,所加的酸溶液是稀硫酸.
②装置乙的作用是吸收二氧化碳中混有的水蒸气;从导管A处缓缓鼓入一定量的空气时,装置甲的作用是吸收鼓入空气中的二氧化碳.
③请利用有关数据计算试样中碳酸氢钠的质量分数.
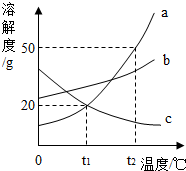 如图是a、b、c 三种固体物质的溶解度曲线.
如图是a、b、c 三种固体物质的溶解度曲线.