题目内容
17.某市水泥厂化验室为了测定当地石灰石中碳酸钙的质量分数,取石灰石样品与足量的稀盐酸在烧杯中反应(石灰石样品中杂质不与稀盐酸反应,也不溶于水).记录有关实验数据如表:| 反应前 | 反应后 | ||
| 实 验 数 据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
| 150g | 15g | 160.6g | |
(1)该反应中生成二氧化碳的质量为4.4g.
(2)此石灰石样品中碳酸钙的质量分数(精确到0.1%).
分析 (1)根据质量守恒定律可知:反应后比反应前减少的质量是生成二氧化碳的质量;
(2)根据化学方程式由二氧化碳的质量可以计算出石灰石中碳酸钙的质量,进而计算出石灰石中碳酸钙的质量分数.
解答 解:(1)根据质量守恒定律,二氧化碳的质量为:150g+15-160.6g=4.4g
2)设该石灰石样品中碳酸钙的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4g
$\frac{100}{x}=\frac{44}{4.4g}$
x=10g
此石灰石中碳酸钙的质量分数为:$\frac{10g}{15g}$×100%≈66.7%
答案:
(1)4.4g
(2)该石灰石中碳酸钙的质量分数为66.7%.
点评 本题主要考查有关化学方程式的计算和质量分数的计算,难度较小.

练习册系列答案
 同步奥数系列答案
同步奥数系列答案
相关题目
7.为探究氢氧化钙溶液和稀盐酸反应所得溶液中溶质的成分,同学们通过测定了反应后溶液的pH,得到了如图1所示的pH曲线,请回答:
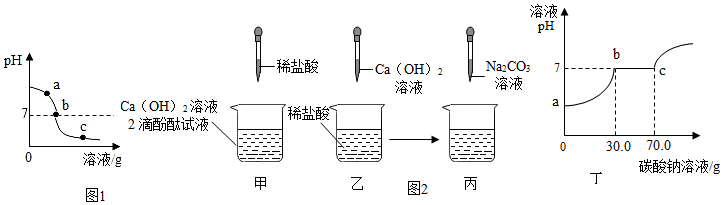
(1)由图可知该实验操作是将稀盐酸 滴加到另一种溶液中
(2)该反应的化学方程式为Ca(OH)2+2HCl═CaCl2+2H2O;
(3)实验过程中,取a、b、c三处反应后的溶液于三个烧杯中,但是忘了作标记,请你设计不同的方案(不再用测定pH的方法),探究三种样品分别属于哪处溶液.
【查阅资料】CaCl2溶液显中性,CaCl2+Na2CO3=CaCO3↓+2NaCl
【探究过程】
①分别取少量样品于三支试管中,加入酚酞试液,观察到其中一支试管内出现溶液由无色变成红色
的现象.结论:该样品是a处溶液.
②为进一步确定b或c处溶液,又设计了以下方案:
(4)同学们做甲、乙两个中和反应实验的探究(如图2).
①甲实验恰好中和,则该溶液中的溶质是CaCl2(化学式).
②取乙反应后的溶液60.0g,滴加质量分数为26.5%的Na2CO3溶液(见丙图),溶液pH的变化如图丁所示.请计算该溶液中CaCl2的溶质质量分数.(写出计算过程,精确到0.1%)

(1)由图可知该实验操作是将稀盐酸 滴加到另一种溶液中
(2)该反应的化学方程式为Ca(OH)2+2HCl═CaCl2+2H2O;
(3)实验过程中,取a、b、c三处反应后的溶液于三个烧杯中,但是忘了作标记,请你设计不同的方案(不再用测定pH的方法),探究三种样品分别属于哪处溶液.
【查阅资料】CaCl2溶液显中性,CaCl2+Na2CO3=CaCO3↓+2NaCl
【探究过程】
①分别取少量样品于三支试管中,加入酚酞试液,观察到其中一支试管内出现溶液由无色变成红色
的现象.结论:该样品是a处溶液.
②为进一步确定b或c处溶液,又设计了以下方案:
| 实验步骤 | 实验现象 | 实验结论 |
| 另取少量余下样品于两支试管中,分别滴加足量的Na CO,溶液 | 只产生白色沉淀 | 该样品为b处溶液 |
| 先产生气泡,后产生白色沉淀 | 该样品为c处溶液,并推知液中的阳离子有Ca2+、H+ |
①甲实验恰好中和,则该溶液中的溶质是CaCl2(化学式).
②取乙反应后的溶液60.0g,滴加质量分数为26.5%的Na2CO3溶液(见丙图),溶液pH的变化如图丁所示.请计算该溶液中CaCl2的溶质质量分数.(写出计算过程,精确到0.1%)
8.下列有关金属材料的说法正确的是( )
| A. | 金属具有光泽,常温下都是固体 | |
| B. | 炒菜后应及时除去铁锅上的水,以防铁锅生锈 | |
| C. | 铝的抗腐蚀性强的原因是因为铝的化学性质不活泼,不与其他物质反应 | |
| D. | 合金的性能优于其组成的纯金属,如硬度更大、熔点更高、耐腐蚀性更好 |
5.下列属于物理变化的是( )
| A. | 木炭燃烧 | B. | 一氧化碳还原氧化铁 | ||
| C. | 二氧化碳使澄清石灰水变浑浊 | D. | 活性炭使红糖脱色 |
 如图为某同学进行电解水实验的装置图,据此回答:
如图为某同学进行电解水实验的装置图,据此回答:
 为某粒子的结构示意图,当A-B=10时,该粒子是原子(填原子、阳离子或阴离子);例如Na(填化学用语)当B=8时,若该粒子带1个单位的正电荷,则该粒子的符号是K+;若该粒子带1个单位的负电荷,则该粒子的符号是Cl-.
为某粒子的结构示意图,当A-B=10时,该粒子是原子(填原子、阳离子或阴离子);例如Na(填化学用语)当B=8时,若该粒子带1个单位的正电荷,则该粒子的符号是K+;若该粒子带1个单位的负电荷,则该粒子的符号是Cl-.