题目内容
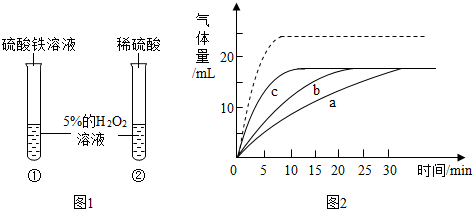
7.为探究氢氧化钙溶液和稀盐酸反应所得溶液中溶质的成分,同学们通过测定了反应后溶液的pH,得到了如图1所示的pH曲线,请回答: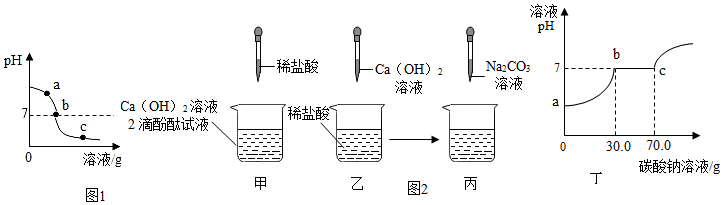
(1)由图可知该实验操作是将稀盐酸 滴加到另一种溶液中
(2)该反应的化学方程式为Ca(OH)2+2HCl═CaCl2+2H2O;
(3)实验过程中,取a、b、c三处反应后的溶液于三个烧杯中,但是忘了作标记,请你设计不同的方案(不再用测定pH的方法),探究三种样品分别属于哪处溶液.
【查阅资料】CaCl2溶液显中性,CaCl2+Na2CO3=CaCO3↓+2NaCl
【探究过程】
①分别取少量样品于三支试管中,加入酚酞试液,观察到其中一支试管内出现溶液由无色变成红色
的现象.结论:该样品是a处溶液.
②为进一步确定b或c处溶液,又设计了以下方案:
| 实验步骤 | 实验现象 | 实验结论 |
| 另取少量余下样品于两支试管中,分别滴加足量的Na CO,溶液 | 只产生白色沉淀 | 该样品为b处溶液 |
| 先产生气泡,后产生白色沉淀 | 该样品为c处溶液,并推知液中的阳离子有Ca2+、H+ |
①甲实验恰好中和,则该溶液中的溶质是CaCl2(化学式).
②取乙反应后的溶液60.0g,滴加质量分数为26.5%的Na2CO3溶液(见丙图),溶液pH的变化如图丁所示.请计算该溶液中CaCl2的溶质质量分数.(写出计算过程,精确到0.1%)
分析 (1)根据溶液的pH变化情况来分析;
(2)考虑酸碱中和生成盐和水,根据反应原理来书写;
(3)根据溶液的酸碱性以及碳酸钠的化学性质来分析.物质之间发生化学反应时,可能恰好完全反应,也可能有的反应物有剩余;合理设计实验,通过实验现象可以判断物质的组成情况.
(4)①根据盐酸和氢氧化钙的反应进行分析;
②反应后的溶液是氯化钙溶液,和碳酸钠溶液反应生成碳酸钙沉淀,根据化学反应方程式进行分析计算.
解答 解:(1)由图象可知,该溶液的pH由大到小,说明是向碱溶液中滴加酸;
(2)因为氢氧化钙与稀盐酸反应生成氯化钙和水;故其化学方程式为:Ca(OH)2+2HCl═CaCl2+2H2O;
(3)【探究过程】
①根据图可知:a处的溶液显碱性,加入酚酞试液,观察到其中一支试管内出现溶液由无色变成红色的现象;
②根据图可知:b处溶液为氢氧化钙与稀盐酸恰好反应,生成氯化钙中性溶液;而c处的溶液显酸性,溶液中的溶质是氯化钙和氯化氢,其中的阳离子是钙离子和氢离子,溶液显酸性,加入碳酸钠后,先与稀盐酸反应生成二氧化碳气体,当盐酸完全反应后再与氯化钙反应生成白色沉淀;
(4)①盐酸和氢氧化钙的反应生成氯化钙和水,恰好中和后,溶液中的溶质只有氯化钙;
②由图可知,碳酸钠溶液的量到70g时,反应正好完成;氯化钙和碳酸钠的反应生成碳酸钙和水,据题意,设参加反应的CaCl2的质量为x,则
CaCl2+Na2CO3=CaCO3↓+2NaCl
111 106
x 40g×26.5%
$\frac{111}{106}=\frac{x}{40g×26.5%}$
解得:x=11.1g
该CaCl2溶液的溶质质量分数为:$\frac{11.1g}{60g}$×100%≈18.5%
故答案为:
(1)稀盐酸;(2)Ca(OH)2+2HCl═CaCl2+2H2O;
(3)①溶液由无色变成红色.②
| 实验步骤 | 实验现象 | 实验结论 |
| 只产生白色沉淀 | ||
| 先产生气泡,后产生白色沉淀 | Ca2+、H+. |
点评 本题考查了碱的化学性质,学生应熟悉碱的通性,并能利用信息结合碱的性质来解决问题,(1)中反应与图象相结合,明确图象中曲线的变化是解答的关键.

 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案 小明同学在“××雪饼”的包装袋内发现一小包干燥剂,干燥剂袋上的部分文字见右下图.过几天后小明发现纸袋内的白色颗粒粘在一起成为块状固体M.请回答下列问题:
小明同学在“××雪饼”的包装袋内发现一小包干燥剂,干燥剂袋上的部分文字见右下图.过几天后小明发现纸袋内的白色颗粒粘在一起成为块状固体M.请回答下列问题:(1)这包干燥剂的主要成分吸水的过程中,发生反应的化学方程式是:CaO+H2O=Ca(OH)2
(2)请你与他一起对块状固体M进行探究.
①探究固体M是否失效;
②探究固体M中是否含有氢氧化钙.
【探究方案】
| 问题与猜想 | 实验步骤 | 实验现象 | 实验结论 |
| 探究一:固体M是否失效 | 取适量固体M,加入盛有水的烧杯中,用温度计测量加入前后的温度 | 温度没有明显变化 | 没有氧化钙 |
| 探究二:固体M中是否含有氢氧化钙 | 将上述烧杯内的液体充分搅拌、静置,取上层清液,加入无色酚酞试液 | 酚酞试液变红 | 有氢氧化钙 |
(3)你认为“探究二”是否严,其原因是不严密,氢氧化钙也可能是未变质的氧化钙与水反应刚生成的.
【提出猜想】猜想一:只有CaCl2; 猜想二:CaCl2和HCl.
【实验探究】为了验证猜想,该兴趣小组的同学设计了如下实验方案.
| 方案编号 | 方案1 | 方案2 |
| 实验操作 (分别取少量实验后的溶液于试管中) | 加入少许氧化铁 | 滴加硝酸银溶液 |
| 实验现象 | 固体逐渐消失,溶液由无色变成黄色 | 产生白色沉淀. |
| 实验结论 | 猜想二成立. | |
(2)有同学提出方案2是错误的,原因是氯化钙和稀盐酸都能够和硝酸银反应生成白色沉淀氯化银.
(3)该兴趣小组的小华同学观察到石灰石和稀盐酸反应后容器内有少量固体剩余,得出溶液中肯定没有盐酸的结论,其他同学认为小华的说法不合理,其理由是剩余的少量固体可能是不能和稀盐酸反应的杂质.
【拓展延伸】石灰石的主要成分碳酸钙可用作补钙剂.某补钙药剂说明书的部分信息如图1所示.现将100g盐酸分成5等份,逐次加到用40片该药剂制成的粉末中(其他成分不与盐酸反应),得到部分数据与图象如图2.请根据有关信息回答问题.
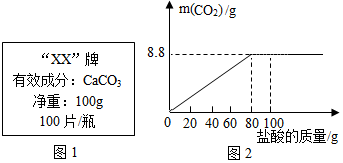
| 第1次 | 第3次 | 第4次 | |
| 加入盐酸的质量(g) | 20 | 20 | 20 |
| 剩余固体的质量(g) | 35 | a | 20 |
(2)求该盐酸中溶质的质量分数为多少?(写出计算过程,计算结果保留一位小数).

(1)实验前应先做的是检查装置的气密性.
(2)实验中可观察到的现象是红色固体变黑,澄清的石灰水变浑浊,尾气燃烧,产生蓝色火焰.
(3)小龙认为刚通入CO时不能马上进行尾气处理,这样不安全,他的理由是装置中含有空气,此时的尾气中含有空气,点燃含有空气的一氧化碳时易发生爆炸.
小丽用上述实验中得到的铁与过量的硫酸铜溶液反应,结果发现有部分黑色固体剩余,于是提出了疑问:
【提出问题】炼铁过程中除了生成铁以外还生成了什么?
【查阅质量】
①铁在高温条件下可与水蒸气反应生成一种铁的氧化物和氢气.
②铁和铁的氧化物中只有铁、Fe3O4能被磁铁吸引.
【猜想与假设】
①可能是FeO;
②可能是Fe2O3;
③可能是Fe3O4.
【实验探究】
(4)小丽马上排除了猜想②,理由是Fe2O3是红色粉末.
| 实验方案 | 现象与结论 |
| 观察到黑色粉末全部被磁铁吸引,说明猜想③正确. | |
| 反应前 | 反应后 | ||
| 实 验 数 据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
| 150g | 15g | 160.6g | |
(1)该反应中生成二氧化碳的质量为4.4g.
(2)此石灰石样品中碳酸钙的质量分数(精确到0.1%).