题目内容
10.炼铁产生的废渣中含有大量CuS及少量铁和铁的化合物,工业上以该废渣为原料生产CuCl2的流程图如图所示:
(1)②中CuS、NaCl和O2在高温条件下反应生成了CuCl2和Na2SO4,其反应化学方程式是CuS+2NaCl+2O2$\frac{\underline{\;高温\;}}{\;}$CuCl2+Na2SO4.
(2)③的操作名称是过滤.
(3)该流程中能循环利用的物质是NaCl.
分析 (1)根据反应②写出反应的化学方程式;
(2)根据过滤的原理分析回答;
(3)根据流程中物质的变化分析.
解答 解:(1)在②中CuS、NaCl和O2在高温条件下反应生成了CuCl2和Na2SO4,其反应化学方程式是:CuS+2NaCl+2O2$\frac{\underline{\;高温\;}}{\;}$CuCl2+Na2SO4.
(2)③的操作能将固液分开,名称是过滤;
(3)由流程可知,反应过程中加入了氯化钠,最后又生成了氯化钠,所以循环利用的物质是NaCl.
故答为:(1)CuS+2NaCl+2O2=CuCl2+Na2SO4;(2)过滤;(3)NaCl.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案
相关题目
19.如图中●和○表示不同元素的原子,由图可以获得的信息是( )
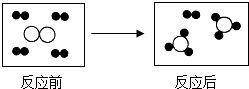

| A. | 反应后生成两种物质 | |
| B. | 参加反应各物质的分子个数比为1:4 | |
| C. | 反应前后原子的种类没有改变 | |
| D. | 该反应的基本类型是置换反应 |
20.如表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
①40℃时,氯化钠的溶解度为36.6g/100g水;
②碳酸钠溶液中混有少量的氯化钠,可通过降温结晶(或冷却热的饱和溶液)的方法提纯;
③碳酸钠的溶解度随温度的升高而增大(填“增大”或“减小”).在20℃时,将100g水加入30g碳酸钠中,充分搅拌后得到的是饱和(填“饱和”或“不饱和”)溶液,将上述溶液升温到30℃,该溶液的溶质质量分数为23.1%.
| 温度/℃ | 10 | 20 | 30 | 40 | |
| 溶解度 g/100gH2O | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
| 碳酸钠 | 12.2 | 21.8 | 39.7 | 53.2 | |
②碳酸钠溶液中混有少量的氯化钠,可通过降温结晶(或冷却热的饱和溶液)的方法提纯;
③碳酸钠的溶解度随温度的升高而增大(填“增大”或“减小”).在20℃时,将100g水加入30g碳酸钠中,充分搅拌后得到的是饱和(填“饱和”或“不饱和”)溶液,将上述溶液升温到30℃,该溶液的溶质质量分数为23.1%.


 如图是A、B两种物质的溶解度曲线,请填空:
如图是A、B两种物质的溶解度曲线,请填空: