题目内容
12.实验是进行科学探究的重要途径.(1)实验室在制取气体时必不可少的步骤是检查装置的气密性.
(2)氨气(NH3)是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,氨水显碱性.实验室里加热氯化铵(NH4Cl)和熟石灰两种固体的混合物可制取氨气,同时生成氯化钙和水.
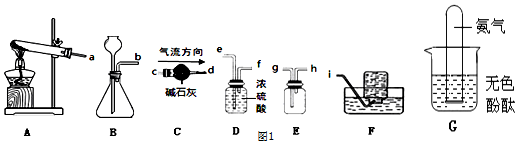
①实验室制取氨气的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
②若要制取NH3,应该选用图1的发生装置是A(填字母);若要收集到干燥的NH3,应该选用仪器的导管接口从左到右的连接顺序为:发生装置出口接c、d接h.
③如图1G,若将收集满氨气的大试管倒扣在滴有无色酚酞的水中,观察到的现象是试管中液面上升且溶液变红色.
(3)某化工厂排出的废液中含有AgNO3、Zn(NO3)2和Cu(NO3)2三种物质,某化学课外小组的同学设计了如图2实验方案:
①写出操作一的化学方程式:Cu+2AgNO3=Cu(NO3)2+2Ag;
②若固体Y加稀硫酸无气泡产生,滤液B中的溶质最多有4种.
③滤液A的质量>(填“>”、“<”或“=”)废液的质量.
(4)小华实验操作考试的题目是:配制一定溶质质量分数的碳酸钠溶液并测定其酸碱度.考试时,小华进行了如图3所示的操作:(已知碳酸钠溶液呈碱性)
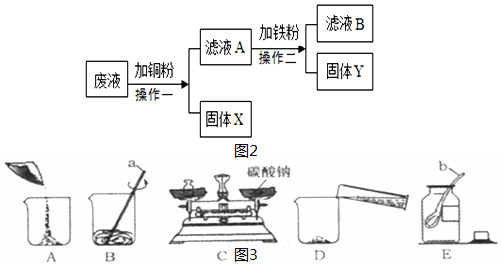
①请填写标号仪器的名称:a.玻璃棒;b.药匙.
②以上实验的正确操作顺序为ECADB(用序号字母表示).
③上图所示操作中,若C中砝码为12g,游码的读数为2.5g,则碳酸钠实际质量为9.5g.
④小华在测定所配制溶液的酸碱度时,先将pH试纸用蒸馏水湿润,再进行测定,则测的溶液的pH值
偏小(选填“偏大”、“偏小”或“不受影响”)
分析 (1)实验室制取气体的装置在加入药品前要检查装置的气密性,防止装置漏气;
(2)①据反应原理书写方程式;
②据反应物状态和反应条件选择发生装置;浓硫酸与氨气反应生成硫酸铵,故不能用浓硫酸干燥氨气,应用碱石灰干燥,氨气密度比空气小,所以若要制取干燥的NH3,须用向下排空气法,则从短管进气;
③氨气极易溶于水,则试管内气压减小,液面上升;其水溶液为氨水,显碱性,能使酚酞试液变红;
(3)①金属活动性顺序中,前面的金属可以把排在它后面的金属从盐溶液中置换出来;
②固体Y加入稀硫酸无气泡生成,说明无剩余的铁,并按反应流程进行分析;
③据铜和硝酸银反应原理分析解答;
(4)①熟记常见仪器的名称;
②根据配制溶液的步骤考虑;
③根据左码右物称量时质量的算法考虑;
④根据碳酸钠的酸碱性考虑.
解答 解:(1)实验室制取气体的装置在加入药品前要检查装置的气密性,防止装置漏气;
(2)①加热氯化铵(NH4Cl)和熟石灰两种固体的混合物可制取氨气,同时生成氯化钙和水,反应方程式是:Ca(OH)2+2NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
②浓硫酸与氨气反应生成硫酸铵,故不能用浓硫酸干燥氨气,应用碱石灰干燥,氨气密度比空气小,所以若要制取干燥的NH3,须用向下排空气法,则从短管进气,故所选用仪器的导管接口从左到右的连接顺序应为a→c→d→h;
③氨气水溶液为氨水,能使酚酞试液变红,说明其溶液显碱性,所以可将湿润的红色石蕊试纸放于集气瓶口长管处,若试纸变蓝,说明收集满了;
(3)①由于铜的金属活动性比锌弱,比银强,因此把铜粉放到废液中时,铜粉可以和硝酸银反应生成银和硝酸铜,反应方程式是:Cu+2AgNO3=Cu(NO3)2+2Ag;
②所以滤液A中一定含有硝酸铜和硝酸锌,若操作乙加入的铜不足,则A中还含有硝酸银,铁、铜、银三种金属的活动性由强到弱的顺序是:铁>铜>银,铁优先置换溶液中的银,则固体Y中一定有银,加稀硫酸无气泡产生,说明铁粉不足,可能滤液中的硝酸银未反应完,则滤液中的溶质最多有四种,是硝酸银、未反应的硝酸铜,生成的硝酸亚铁,和不与铁反应的硝酸锌;
③由Cu+2AgNO3=Cu(NO3)2+2Ag,
340 188
可知340g的硝酸银反应生成188g的硝酸铜,溶质的质量减小,所以废液的质量大于滤液的质量;
(4)①标号仪器分别是玻璃棒和药匙;
②配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放,操作顺序是:ECADB;
③左码右物称量时称量物的质量=砝码的质量-游码的质量=12g-2.5g=9.5g;
④由于碳酸钠显碱性,pH值大于7,用水湿润后,因为水的pH值等于7,所以结果会偏小;
故答案为:(1)检查装置的气密性;
(2)①Ca(OH)2+2NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;②A;c→d→h;
(3)①Cu+2AgNO3=Cu(NO3)2+2Ag;②4;③>;
(4)①玻璃棒; 药匙;②ECADB;③9.5; ④偏小.
点评 本题考查知识综合而全面,既考查了实验室制取气体的反应原理、装置连接、气体的验满,又考查了顺序表的应用(金属和盐溶液反应时,金属之间活动性差距越大,越易反应)、溶液的配制等知识,能较好考查学生应用知识解决问题的能力.

(1)氮气是无色无味的气体物理性质;
(2)煤燃烧化学变化;
(3)水沸腾变成水蒸汽物理变化;
(4)铁丝能在氧气中剧烈燃烧化学性质.
| A. | a+b=m+n | B. | 2a=m | C. | m=n | D. | b=m+n |
| A. |  水的电解 | |
| B. |  在密闭容器中红磷完全燃烧 | |
| C. |  加热一定质量的高锰酸钾制氧气 | |
| D. |  等质量的锌、铁分别与足量等浓度的稀硫酸反应 |

| A. | t1℃时,溶解度:甲<乙 | |
| B. | t2℃时,甲乙两物质的饱和溶液溶质的质量分数相等 | |
| C. | 将t1℃时的乙饱和溶液升温到t2℃,所得溶液为饱和溶液 | |
| D. | 将t3℃甲、乙两种物质的饱和溶液,降温至t2℃,析出晶体的质量:甲>乙 |
 如图是A.B.C三种物质的溶解度曲线
如图是A.B.C三种物质的溶解度曲线 甲、乙、丙三种物质的溶解度曲线如图所示,根据图中信息回答下列问题:
甲、乙、丙三种物质的溶解度曲线如图所示,根据图中信息回答下列问题: