题目内容
8.根据如图装置,结合所学化学知识回答下列问题: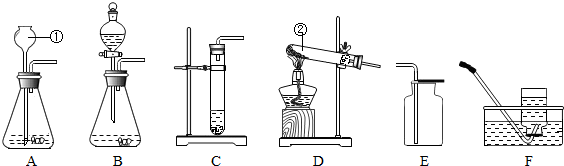
(1)写出图中标号仪器的名称:①长颈漏斗;②试管.
(2)实验室制取少量CO2时,发生装置最好选用C(填字母,下同),收集装置选用E,只能用此法收集气体的原因是二氧化碳能溶于水,密度比空气大.如果需随时控制反应速率并节约药品,发生装置最好选用B
(3)实验室用高锰酸钾制取氧气时,发生装置应选用D,其反应的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,反应类型为分解反应.
(4)如用F装置收集氧气,判断氧气是否收集满的方法是将带火星的木条放在瓶口木条复燃则已满.
(5)如果改用氯酸钾和二氧化锰制氧气,反应前后MnO2的质量分数增大 (填“增大”、“减小”或“不变”)
(6)在实验室里,可用硫化亚铁固体和稀硫酸的反应来制取H2S气体.在通常状况下,H2S是一种无色、有臭鸡蛋气味的有毒气体,能溶于水且水溶液呈酸性,密度比空气的大,实验室制取H2S应选用的发生装置是B(填字母),实验结束后,剩余的H2S气体应该用氢氧化钠溶液来吸收,防止污染空气.
分析 (1)熟悉常用化学仪器,了解它们的名称及用途;
(2)根据反应物的状态和反应条件选择发生装置和气体的收集方法选择的依据;
(3)根据反应物的状态和反应条件选择发生装置的依据解答;
(4)根据排水集气法判断集满方法解答.
(5)根据氯酸钾和二氧化锰制取氧气,反应后物质总质量小于反应前物质的质量解答;
(6)根据反应物的状态和反应条件选择发生装置的依据解答;硫化氢气体的性质解答;
解答 解:
(1)根据标号仪器的图形可知,仪器的名称是:①长颈漏斗,②试管;
(2)制取二氧化碳选用石灰石和稀盐酸常温下反应,所以选用固液混合不加热装置,制取少量的选用试管不用锥形瓶,二氧化碳能溶于水不能用排水法收集,二氧化碳密度比空气密度大,可选用向上排空气法收集;分液漏斗能控制液体的滴加,所以能随时控制生产气体的量并节约药品;
(3)实验室用高锰酸钾制取氧气时,需要加热,属于固固加热型,加热高锰酸钾时生成了锰酸钾、二氧化锰、氧气,反应的方程式是:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;符合一变多,属于分解反应;
(4)用F装置收集氧气,判断氧气是否收集满的方法将带火星的木条放在瓶口木条复燃则已满;
(5)用氯酸钾和二氧化锰制取氧气,反应前后二氧化锰的质量不变,而固体的总质量减少,反应前后二氧化锰的质量分数增大;
(6)用硫化亚铁固体和稀硫酸的反应来制取硫化氢气体,需选择固液不需加热的发生装置B,由于硫化氢气体能溶于水且水溶液呈酸性,故可以用氢氧化钠溶液吸收剩余的硫化氢气体.
故答案为:
(1)长颈漏斗,试管;
(2)C;E;二氧化碳能溶于水,密度比空气大;B;
(3)D;2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;分解反应;.
(4)将带火星的木条放在瓶口木条复燃则已满;
(5)增大;
(6)B,氢氧化钠.
点评 本题主要考查了氧气的实验室制取.要解答好这类题目,就要熟记氧气的实验室制取原理和氧气的溶解性、密度等;还要熟悉常见仪器的用途、基本的实验操作及注意事项等等.

| A. | 二氧化碳 | B. | 氯酸钾 | C. | 二氧化锰 | D. | 液氧 |
| A. |  量取液体 量取液体 | B. |  滴加液体 滴加液体 | ||
| C. |  检查装置的气密性 检查装置的气密性 | D. |  测溶液pH 测溶液pH |
| A. | 有机物:甲烷、乙醇、醋酸 | |
| B. | 复合肥料:尿素、硝酸钾、磷酸二氢铵 | |
| C. | 混合物:煤、石油、冰水共存物 | |
| D. | 合成材料:羊毛、合成橡胶、焊锡 |
| A. | 煤气是由一氧化碳、甲烷、氢气等组成的有机物 | |
| B. | 塑料、合成橡胶、合金都属于合成材料 | |
| C. | 氧气、白磷、硫都是具有可燃性的单质 | |
| D. | 煤、石油、天然气都是化石能源,属于混合物 |
| A. | 因为甲醛能使蛋白质变性,起到防腐作用,所以甲醛水溶液可用于浸泡水产品 | |
| B. | 降低温度能够灭火,所以油锅着火可以用浇水降温的方法灭火 | |
| C. | 酸能够使紫色石蕊溶液变红,二氧化碳能使紫色石蕊溶液变红色,所以二氧化碳是酸 | |
| D. | 氧化物中含有氧元素,但是含有氧元素的化合物不一定是氧化物 |