题目内容
3.为了探究碱的性质,进行如图所示的实验.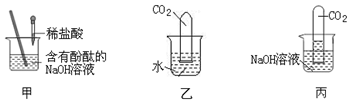
①图甲所示,加入一定量的盐酸后,溶液由红色变为了无色,证明了盐酸和NaOH发生了中和反应,且反应后的溶液中一定没有的溶质是NaOH.张明对甲实验所得溶液的溶质成分产生了兴趣,对反应后溶液变为无色提出了以下两种猜想:
猜想1:溶质成分只有NaCl;
猜想2:溶质成分为HCl和NaCl.
【进行实验】为了验证自己的猜想正确,张明进行了如下实验,请你和他一起完成下列实验报告:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量甲实验所得溶液于试管中,并往试管中加入锌粒 | 观察到有气泡产生 | 猜想2正确 |
分析 根据酚酞试液在碱性溶液中为红色,在酸性和中性溶液中为无色进行分析解答,根据氢氧化钠和盐酸反应生成氯化钠和水、氢氧化钠和二氧化碳反应生成碳酸钠和水以及物质间反应实验现象进行分析解答即可.
解答 解:①氢氧化钠和盐酸反应生成氯化钠和水,溶液由红色变为了无色,说明不存在碱性物质氢氧化钠,故填:NaOH;
猜想2:氢氧化钠和盐酸反应生成氯化钠和水,溶液由红色变为了无色,溶液可能呈酸性,故可能含有的溶质是HCl和NaCl,故填:HCl和NaCl;
【进行实验】要证明盐酸的存在,可以根据酸的性质,能与活泼金属反应产生氢气,故填:锌粒;有气泡产生;
②氢氧化钠与二氧化碳反应生成碳酸钠和水,反应的化学方程式为2NaOH+CO2═Na2CO3+H2O;实验中乙起到的是对照的作用,故填:2NaOH+CO2═Na2CO3+H2O;进行对照,证明NaOH与CO2 发生了反应.
点评 本题考查的是碱的有关性质,完成此题,可以依据已有的物质的性质进行.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列除去杂质的方法中,正确的是( )
| 选项 | 物质(括号内为杂质) | 去除杂质的方法 |
| A | NaCl溶液(Na2CO3) | 加入过量的Ca(NO3)2溶液、过滤 |
| B | CaO(CaCO3) | 加水、过滤 |
| C | Cu(Fe) | 加过量H2SO4溶液、过滤 |
| D | HNO3溶液(H2SO4) | 加适量BaCl2溶液、过滤 |
| A. | A | B. | B | C. | C | D. | D |
18.在学习中要不断总结,归纳发现规律,就能不断提高自己的能力.在标准状况下各气体相对分子质量、密度和实验室收集方法如下表,通过比较找出规律:
(1)从“相对分子质量”和“标况下密度”两列,可归纳出:一般来说,气体相对分子质量越大,标准状况下的密度越大;
(2)密度大于空气的气体可采用向上排空气法收集.
(3)实验室制取的氨气(化学式为NH3),可推测知密度比空气小,可用向下排空气法收集(氨气极易溶于水).
| 气体 | 相对分子质量 | 标况下密度(g/L) | 收集方法 |
| 空气 | 29 | 1.293 | 排水集气法 |
| 氧气 | 32 | 1.429 | 向上排空气法 |
| 二氧化碳 | 44 | 1.964 | 向上排空气法 |
| 氢气 | 2 | 0.089 | 向下排空气法 |
(2)密度大于空气的气体可采用向上排空气法收集.
(3)实验室制取的氨气(化学式为NH3),可推测知密度比空气小,可用向下排空气法收集(氨气极易溶于水).
8.化学工业的飞速发展给我们的生活带来了许多便利,但是一些不合理行为也给环境带来了严重的污染.下列行为不会污染环境的是( )
| A. | 回收废旧塑料减少白色污染 | |
| B. | 提倡使用私家车出行 | |
| C. | 大量使用化肥农药提高农作物的产量 | |
| D. | 将工厂排放废弃的烟囱加高 |
15.如图中的符号表示2个氧分子的是( )
| A. |  | B. |  | C. |  | D. |  |
12.下列物质的用途主要是由其化学性质决定的是( )
| A. | 氧气可用于生物呼吸 | B. | 活性炭可用于除去冰箱中的异味 | ||
| C. | 铜丝可用作导线 | D. | 干冰可用于人工降雨 |
