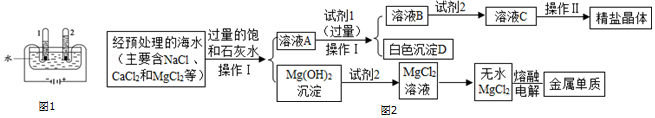
题目内容
13.下列除去杂质的方法中,正确的是( )| 选项 | 物质(括号内为杂质) | 去除杂质的方法 |
| A | NaCl溶液(Na2CO3) | 加入过量的Ca(NO3)2溶液、过滤 |
| B | CaO(CaCO3) | 加水、过滤 |
| C | Cu(Fe) | 加过量H2SO4溶液、过滤 |
| D | HNO3溶液(H2SO4) | 加适量BaCl2溶液、过滤 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答 解:A、Na2CO3能与过量的Ca(NO3)2溶液反应生成碳酸钙沉淀和硝酸钠,能除去杂质但引入了新的杂质硝酸钠、硝酸钙(过量的),不符合除杂原则,故选项所采取的方法错误.
B、CaO能与水反应生成氢氧化钙,碳酸钙难溶于水,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误.
C、Fe能与过量H2SO4溶液反应生成硫酸亚铁溶液和氢气,Cu不与过量H2SO4溶液反应,再过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确.
D、H2SO4能与适量BaCl2溶液反应生成硫酸钡沉淀和盐酸,能除去杂质但引入了新的杂质盐酸,不符合除杂原则,故选项所采取的方法错误.
故选:C.
点评 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案
相关题目
4.浓盐酸敞口放置一段时间后,下列关于浓盐酸溶液pH变化的说法正确的是( )
| A. | 变大 | B. | 变小 | C. | 不变 | D. | 无法确定 |
1.如图表示的是一些物质在常温下的近似pH.下列有关这些物质的说法中,正确的是( )

| A. | 苹果汁的酸性大于酸雨的酸性 | |
| B. | 小苏打水不能使酚酞液变红 | |
| C. | 厨房清洁剂的碱性小于小苏打水的碱性 | |
| D. | 酸雨呈酸性的主要原因是溶有二氧化碳 |
18.在不用指示剂的条件下,欲将含有盐酸的氯化钙溶液由酸性变为中性,下列物品中最适宜的是( )
| A. | 澄清石灰水 | B. | 硝酸银溶液 | C. | 生石灰粉末 | D. | 石灰石粉末 |
3.为了探究碱的性质,进行如图所示的实验.
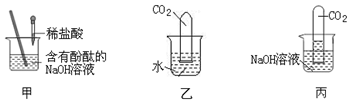
①图甲所示,加入一定量的盐酸后,溶液由红色变为了无色,证明了盐酸和NaOH发生了中和反应,且反应后的溶液中一定没有的溶质是NaOH.张明对甲实验所得溶液的溶质成分产生了兴趣,对反应后溶液变为无色提出了以下两种猜想:
猜想1:溶质成分只有NaCl;
猜想2:溶质成分为HCl和NaCl.
【进行实验】为了验证自己的猜想正确,张明进行了如下实验,请你和他一起完成下列实验报告:
②如图乙和丙所示,同时将两支充满CO2 的相同试管分别倒扣在等体积的水和NaOH溶液中,一段时间后丙中试管内液面高于乙.说明NaOH与CO2 发生了反应,该反应的化学方程式为2NaOH+CO2═Na2CO3+H2O.本实验中乙的作用是进行对照,证明NaOH与CO2发生了反应.

①图甲所示,加入一定量的盐酸后,溶液由红色变为了无色,证明了盐酸和NaOH发生了中和反应,且反应后的溶液中一定没有的溶质是NaOH.张明对甲实验所得溶液的溶质成分产生了兴趣,对反应后溶液变为无色提出了以下两种猜想:
猜想1:溶质成分只有NaCl;
猜想2:溶质成分为HCl和NaCl.
【进行实验】为了验证自己的猜想正确,张明进行了如下实验,请你和他一起完成下列实验报告:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量甲实验所得溶液于试管中,并往试管中加入锌粒 | 观察到有气泡产生 | 猜想2正确 |