题目内容
2. 某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验:取等质量的X、Y、Z分别与足量的溶质质量分数相等的稀硫酸反应,都生成+2价金属的硫酸盐,反应情况如图所示.下列对该图象理解的叙述中,正确的是( )
某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验:取等质量的X、Y、Z分别与足量的溶质质量分数相等的稀硫酸反应,都生成+2价金属的硫酸盐,反应情况如图所示.下列对该图象理解的叙述中,正确的是( )| A. | 金属活动性由强到弱:X、Z、Y | B. | 金属活动性由强到弱:X、Y、Z | ||
| C. | X、Y、Z依次可能是Mg、Zn、Fe | D. | 相对原子质量的大小:Y>Z>X |
分析 在金属活动性顺序中,氢前的金属能与酸反应生成氢气,金属的位置越靠前,与酸反应的速率越快,在坐标中,斜线越陡,据此判断金属的活动性顺序;“足量的溶质质量分数相等的稀硫酸”,等质量的三种金属完全反应,放出氢气的质量多少,可依据化学方程式的计算完成.
解答 解:
A、据图可以看出,X的斜线最陡,反应的速率最快,Y的斜线最平缓,故反应的速率最慢,故金属活动性由强到弱为X>Z>Y,故正确;
B、据图可以看出,X的斜线最陡,反应的速率最快,Y的斜线最平缓,故反应的速率最慢,故其活动性为X>Z>Y,故错误;
C、据图,再结合在金属活动性顺序中,Mg>Zn>Fe,不符合其活动性为X>Z>Y,故错误;
D、等质量的X、Y、Z分别与足量的溶质质量分数相等的稀硫酸反应,都生成+2价金属的硫酸盐,则金属的相对原子质量越大,反应生成氢气的质量越少,所以相对原子质量由大到小的顺序是:Z>Y>X,故错误;
故选A.
点评 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序的意义及相关的计算进行;质量相等的金属与足量酸完全反应放出氢气的多少与金属的相对原子质量成反比,与金属的化合价相成正比.

练习册系列答案
相关题目
13. 化学是在原子、分子、离子水平上研究物质及其变化的科学.
化学是在原子、分子、离子水平上研究物质及其变化的科学.
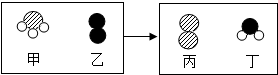
(1)一定条件下,甲和乙反应生成丙和丁(四种物质均由分子构成),反应前后微观示意图如图.下列说法正确的是BE (填序号)
A.反应前后共有4种原子
B.该反应有单质生成
C.反应前后元素化合价都不变
D.化学变化中分子和原子均可再分
E.该化学反应中,甲、丁两种分子的个数比是2:3
(2)胃酸过多须服用抗酸药.下表为两种抗酸药的有效成分及其构成微粒:
由于抗酸药有效成分不同,起抗酸作用(即消耗胃液中盐酸)的微粒也有差异.
①Mg(OH)2起抗酸作用的微粒是OH-(填微粒符号,下同);
②铝碳酸镁与盐酸的反应为:AlMg(OH)3CO3+5HCl═MgCl2+AlCl3+4H2O+CO2↑.
则铝碳酸镁起抗酸作用的两种微粒是OH-、CO32-.
 化学是在原子、分子、离子水平上研究物质及其变化的科学.
化学是在原子、分子、离子水平上研究物质及其变化的科学.(1)一定条件下,甲和乙反应生成丙和丁(四种物质均由分子构成),反应前后微观示意图如图.下列说法正确的是BE (填序号)
A.反应前后共有4种原子
B.该反应有单质生成
C.反应前后元素化合价都不变
D.化学变化中分子和原子均可再分
E.该化学反应中,甲、丁两种分子的个数比是2:3
(2)胃酸过多须服用抗酸药.下表为两种抗酸药的有效成分及其构成微粒:
| 抗胃酸药 | 复方氢氧化镁片 | 铝碳酸镁片 |
| 有效成分 | Mg(OH)2 | AlMg(OH)3CO3 |
| 构成微粒 | Mg2+、OH- | Al3+、Mg2+、OH-、CO32- |
①Mg(OH)2起抗酸作用的微粒是OH-(填微粒符号,下同);
②铝碳酸镁与盐酸的反应为:AlMg(OH)3CO3+5HCl═MgCl2+AlCl3+4H2O+CO2↑.
则铝碳酸镁起抗酸作用的两种微粒是OH-、CO32-.
10.下列化学用语与所表述的意义相符合的是( )
| A. | 3O-3个氧元素 | B. | $\stackrel{+3}{Fe}$-1个铁离子 | ||
| C. | O3-3个氧原子 | D. | SO3-1个三氧化硫分子 |
17.KNO3和NaCl在不同温度时的溶解度如下表:
请回答下列问题:
(1)依据上表数据,绘制出KNO3和NaCl的溶解度曲线如图,图中能表示KNO3溶解度曲线的是A (填“A”或“B”);

(2)由表中数据分析可知,KNO3和NaCl在某一温度时具有相同的溶解度,则温度的取值范围是20℃~30℃;
(3)某兴趣小组做了以下实验:

上述实验过程中得到的溶液一定属于不饱和溶液的是①③④ (填数字序号).
将⑤继续冷却至10℃,过滤,共可回收得到KNO3固体59.1 g,所得滤液中KNO3的溶质质量分数为17.3%.(计算结果保留小数点后1位,不考虑实验过程中水的蒸发)
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
(1)依据上表数据,绘制出KNO3和NaCl的溶解度曲线如图,图中能表示KNO3溶解度曲线的是A (填“A”或“B”);

(2)由表中数据分析可知,KNO3和NaCl在某一温度时具有相同的溶解度,则温度的取值范围是20℃~30℃;
(3)某兴趣小组做了以下实验:

上述实验过程中得到的溶液一定属于不饱和溶液的是①③④ (填数字序号).
将⑤继续冷却至10℃,过滤,共可回收得到KNO3固体59.1 g,所得滤液中KNO3的溶质质量分数为17.3%.(计算结果保留小数点后1位,不考虑实验过程中水的蒸发)
7.葡萄糖(C6H12O6)供给人体活动和维持体温所需能量的反应可表示为:C6H12O6+6O2$\stackrel{酶}{→}$6CO2+6H2O,下列分析错误的是( )
| A. | 葡萄糖属于高分子有机化合物 | |
| B. | 葡萄糖缓慢氧化转变成二氧化碳和水,同时产生能量 | |
| C. | 人呼出的气体和吸入的空气的成分相比,CO2和H2O的含量增加,O2的含量减少 | |
| D. | 葡萄糖氧化产生的CO2如不能及时排出人体,则血液的pH将减小 |
14.下列物质在氧气中燃烧,产生大量白烟的是( )
| A. | 木炭 | B. | 铁丝 | C. | 硫粉 | D. | 红磷 |
11.2015年“世界水日”的主题是“水与可持续发展”.下列关于水的说法中,不正确的是( )
| A. | 硬水和软水可以用肥皂水鉴别 | |
| B. | 地球上的淡水资源是非常丰富的 | |
| C. | 生活中通过煮沸水可以降低水的硬度 | |
| D. | 水是维持人类生命和健康的营养素之一 |
