题目内容
6.下面是某班同学进行研究性学习的过程,请你参与并协助他们完成相关任务.【研究课题】探究草酸晶体受热分解的产物
【查阅资料】草酸的化学式为C2H2O4,草酸晶体熔点较低,加热到182℃时便开始熔化.
【提出猜想】
第一小组同学的猜测是:草酸分解产物只有两种,但是对于具体是哪两种产物,组内同学有以下几种意见:①CO2和CO ②CO和H2O ③CO2和H2O ④CO2和H2 ⑤CO和H2
猜测也应该建立在对已知事实进行充分分析的基础之上,请你根据对草酸化学式的仔细分析,判断以上猜测中①(填序号)一定是不可能的.
第二小组同学认为草酸分解产物有三种,他们的猜测是:草酸分解产物为CO2、CO和H2O
【设计方案】第二小组的同学继续利用下图所示装置进行“第二小组猜想”的实验探究.已知:A、C、F中盛装澄清石灰水,B中盛装浓NaOH溶液,D中装有碱石灰,E中装有CuO.

证明分解产物中有CO2的现象是装置A中澄清石灰水变浑浊;证明分解产物中一定有CO的现象是装置E中黑色氧化铜变为红色固体,且装置F中澄清石灰水变浑浊
若未连接装置G,要达到同样的目的,可采取的措施是酒精灯点燃尾气或直接用气球收集.
分析 【提出猜想】
根据质量守恒定律分析判断回答;
【设计方案】草酸分解得到的产物可能为:H2O、CO和CO2,要检验气体组成,即要检验二氧化碳和一氧化碳,由各装置内试剂可知,A装置是检验二氧化碳,B是除去二氧化碳,C是检验二氧化碳是否除尽,D是干燥气体,E是检验是否有一氧化碳存在,F检验氧化铜和气体反应是否生成二氧化碳,G用来收集没反应的一氧化碳;
解答 解:【提出猜想】
由质量守恒定律可知,化学反应前后元素的种类不变,故第①种猜测是错误的;
【设计方案】二氧化碳和澄清石灰水反应生成碳酸钙沉淀,故装置A中澄清石灰水变浑浊说明有二氧化碳生成,再用装置B除去二氧化碳,用装置C检验二氧化碳是否除净;
一氧化碳具有还原性,可把氧化铜还原成铜,同时生成二氧化碳,故现象为黑色变为红色,F中澄清石灰水变浑浊,
由于一氧化碳有毒,所以要进行尾气处理,若未连接装置G,可用酒精灯点燃尾气或直接用气球收集.
故答案为:装置A中澄清石灰水变浑浊;装置E中黑色氧化铜变为红色固体,且装置F中澄清石灰水变浑浊;酒精灯点燃尾气或直接用气球收集.
点评 本题考查草酸结晶水的测定及草酸分解产物的检验,题目较为综合且具有一定难度,做题时注意反应原理及装置图中所给的物质所起作用及题给信息.

练习册系列答案
相关题目
4.下列“化学之最”中,你认为不正确的是( )
| A. | 水是最常用的溶剂 | B. | 金刚石是最硬的物质 | ||
| C. | 氢气是最清洁的能源 | D. | 银是常见金属中导电性最好的金属 |
2.下列化合物能由金属与稀盐酸或稀硫酸发生置换反应直接制取的是( )
| A. | FeCl3 | B. | ZnCl2 | C. | CuCl2 | D. | CuSO4 |
1. 众所周知,酚酞溶液遇NaOH溶液变红.但是,在分组实验中(如图所示),出现了意想不到的现象:溶液变红后褪色.
众所周知,酚酞溶液遇NaOH溶液变红.但是,在分组实验中(如图所示),出现了意想不到的现象:溶液变红后褪色.
【提出问题】分组实验中,出现意想不到的现象的原因是什么呢?
【猜想与假设】
Ⅰ.红色褪去,与NaOH溶液和空气中的CO2反应有关.
Ⅱ.红色褪去,与NaOH溶液的浓度有关.
进行实验】
【解释与结论】
(1)实验1的现象表明,猜想与假设1不成立(填“成立”或“不成立”).
(2)由实验2得出结论:出现“溶液变红后褪色”现象的原因是与氢氧化钠溶液的浓度有关,氢氧化钠溶液浓度过高会使酚酞退色.
 众所周知,酚酞溶液遇NaOH溶液变红.但是,在分组实验中(如图所示),出现了意想不到的现象:溶液变红后褪色.
众所周知,酚酞溶液遇NaOH溶液变红.但是,在分组实验中(如图所示),出现了意想不到的现象:溶液变红后褪色.【提出问题】分组实验中,出现意想不到的现象的原因是什么呢?
【猜想与假设】
Ⅰ.红色褪去,与NaOH溶液和空气中的CO2反应有关.
Ⅱ.红色褪去,与NaOH溶液的浓度有关.
进行实验】
| 实验 | 实验操作 | 实验现象 |
| 1 | 向盛有2mLNa2CO3溶液的试管中滴加5滴0.5%的酚酞溶液 | 溶液变红 |
| 2 | 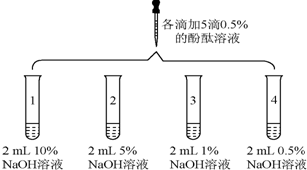 | 1号试管0.1min红色褪去 2号试管5min红色褪去 3号试管30min红色明显变浅 4号试管120min红色无明显变化 |
(1)实验1的现象表明,猜想与假设1不成立(填“成立”或“不成立”).
(2)由实验2得出结论:出现“溶液变红后褪色”现象的原因是与氢氧化钠溶液的浓度有关,氢氧化钠溶液浓度过高会使酚酞退色.

 ”表示一个氯原子,则“
”表示一个氯原子,则“ ”表示Cl2(填化学符号)
”表示Cl2(填化学符号) 轻质碳酸镁 是制取氧化镁、颜料、油漆、日用化妆品的工业原料.
轻质碳酸镁 是制取氧化镁、颜料、油漆、日用化妆品的工业原料. 如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点.据图回答:
如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点.据图回答: