题目内容
17.为了测定Cu-Zn合金,小娟取该合金的粉末12.1g,与足量稀硫酸充分反应后,经测定产生了0.2g气体,请你帮助她计算出该合金中锌的质量分数.分析 根据生成氢气质量,由反应的化学方程式计算出产生合金中锌的质量,进而求出铜的质量以及该合金中铜的质量分数即可.
解答 解:设参加反应的锌的质量为x.
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.2g
$\frac{65}{x}$=$\frac{2}{0.2g}$
x=6.5g.
则合金中锌的质量分数是:$\frac{6.5g}{12.1g}$×100%≈53.72%.
答:该合金中锌的质量分数是53.72%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,解题时要注意解题的规范性.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
12.下列各组物质中,所含分子数相同的是( )
| A. | 224mL H2(标准状况)和0.5molN2 | B. | 5.6L N2(标准状况)和5.6g CO2 | ||
| C. | 11.2L H2O(标准状况)和0.5molBr2 | D. | 10g N2和10g CO |
2.下列关于水的说法正确的是( )
| A. | 水是由2个氢原子和一个氧原子构成 | |
| B. | 矿泉水是纯天然饮品,不含任何化学物质 | |
| C. | 水在化学反应中只充当溶剂不参加反应 | |
| D. | 日常生活中的水大多是混合物 |
6.同学们用碳酸钠溶液和盐酸的反应验证质量守恒定律,实验后他们对残留废液的成分进行探究.
【推理假设】上述两种物质发生反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑,由此推测出废液中一定有NaCl,可能有Na2CO3或盐酸.
【实验探究】(1)确定废液中是否含有盐酸:
①选择试剂:根据盐酸的化学性质,同学们选用了如图所示的五种物质,其中物质X是酸碱指示剂中的石蕊溶液.
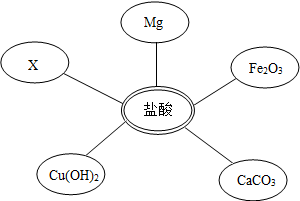
②实验验证:某同学向废液中加入少量的镁粉,观察到无气泡产生(或无现象或无变化),确定废液中一定没有盐酸.
(2)确定废液中是否含有Na2CO3:某同学选用pH试纸(或pH计)测出废液的pH=l0,确定废液中一定含有Na2CO3.
(3)处理废液,回收利用:欲从废液中得到纯净的NaCl,请完成如下实验方案设计.
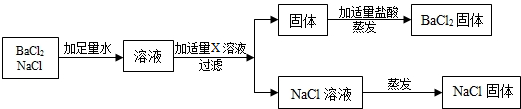
(4)拓展运用:按如图方案分离BaCl2和NaCl的固体混合物时,X溶液中溶质是Na2CO3.相关反应方程式如下Na2CO3+BaCl2=BaCO3↓+2NaCl;BaCO3+2HCl=BaCl2+H2O+CO2↑.
【推理假设】上述两种物质发生反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑,由此推测出废液中一定有NaCl,可能有Na2CO3或盐酸.
【实验探究】(1)确定废液中是否含有盐酸:
①选择试剂:根据盐酸的化学性质,同学们选用了如图所示的五种物质,其中物质X是酸碱指示剂中的石蕊溶液.

②实验验证:某同学向废液中加入少量的镁粉,观察到无气泡产生(或无现象或无变化),确定废液中一定没有盐酸.
(2)确定废液中是否含有Na2CO3:某同学选用pH试纸(或pH计)测出废液的pH=l0,确定废液中一定含有Na2CO3.
(3)处理废液,回收利用:欲从废液中得到纯净的NaCl,请完成如下实验方案设计.
| 方案 | 加入试剂 | 提纯的方法 | 方案评价 |
| 一 | 适量Ca(NO3)2溶液 | 过滤、蒸发结晶 | (选填可行或不可行) |
| 二 | 稍过量的盐酸(或稀HCl或HCl) | 蒸发结晶 | 可行 |


 自行车是比较常见的一种交通工具.制作自行车使用最多的金属是铁.铁在空气中往往容易生锈.人们为了防止铁制品生锈.在自行车的不同部位采取不同的防锈措施.例如:支架采取的防锈措施是刷漆,其防锈原理是隔绝氧气和水.
自行车是比较常见的一种交通工具.制作自行车使用最多的金属是铁.铁在空气中往往容易生锈.人们为了防止铁制品生锈.在自行车的不同部位采取不同的防锈措施.例如:支架采取的防锈措施是刷漆,其防锈原理是隔绝氧气和水.
 合金是重要的金属材料.
合金是重要的金属材料.