题目内容
7.某天然矿泉水的主要成份如下,请认真阅读后填空.
(1)“Mg2+”中数字“2”的含义是每个镁离子带的电荷数.
(2)该矿泉水显碱性(选填“酸”、“碱”或“中”).
(3)该矿泉水是混合物(选填“混合物”或“纯净物”)
分析 (1)数字的位置不同,表示的意义不同;
(2)根据pH与溶液酸碱性的关系来分析;
(3)根据纯净物是由一种的物质;混合物是由两种或多种物质组成的物质进行解答.
解答 解:(1)右上角数字表示离子所带电荷数,故Mg2+表示一个镁离子带两个单位的正电荷;故填:每个镁离子带的电荷数;
(2)由标签内容可知,钙矿泉水的pH为7.8±0.5,pH>7,显碱性;故填:碱;
(3)根据纯净物是由一种的物质;混合物是由两种或多种物质组成的物质;由矿泉水的主要成份可知该矿泉水是混合物,故答案为:混合物.
点评 本题主要考查学生对化学用语的意义的理解,及对纯净,混合物的理解,灵活应用于解题中.

练习册系列答案
相关题目
15.如图为元素周期表第三周期的一部分.据此判断下列说法中正确的是( )
| 11 Na 22.99 | 12 Mg 24.31 | 13 Al 26.98 | 14 Si 28.09 |
| A. | Al的相对原子质量是26.98g | |
| B. | Si的元素名称是硅,其核电荷数为14 | |
| C. | 镁元素的相对原子质量为l2 | |
| D. | 它们都属于金属元素 |
2.生活中的下列变化,属于化学变化的是( )
| A. | 冰块受热熔化 | B. | 熨斗通电后变热 | ||
| C. | 吃进的食物被消化 | D. | 矿石粉碎 |
19.要使100g溶质质量分数为15%的硝酸钾溶液的溶质质量分数变为20%,下列措施:
①加入硝酸钾5g ②加入硝酸钾6.25g ③蒸发水25g④蒸发水75g,其中可行的是( )
①加入硝酸钾5g ②加入硝酸钾6.25g ③蒸发水25g④蒸发水75g,其中可行的是( )
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
16.一天,某少年按如图时间就餐,在不刷牙的情况下口腔内的液体pH在一天中的变化如图,从图中可以看出进食10分钟左右,残留在口腔的食物会转变为酸性还是碱性?( )
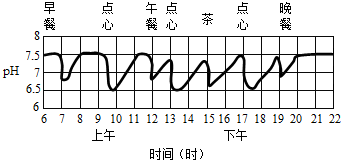

| A. | 酸性 | B. | 碱性 | ||
| C. | 中性 | D. | 有时酸性,有时碱性 |
17.根据如图信息判断下列说法中正确的是( )


| A. | 该元素原子的质子数为15 | |
| B. | 该元素的元素符号是磷 | |
| C. | 该元素属于金属元素 | |
| D. | 该元素原子的相对原子质量为30.97g |
