题目内容
12.某气体含氧气、二氧化硫和三氧化硫中的一种或几种,该气体中硫元素的质量分数为40%,则该气体的组成可能为(1)SO3(2)SO2、O2( 3 )SO2、O2和SO3.
分析 本题可利用元素质量分数的计算,在SO2中硫元素的质量分数为$\frac{32}{32+16×2}$×100%=50%,三氧化硫中的硫元素的质量分数=$\frac{32}{32+16×3}$×100%=40%,在O2中不含硫元素,即硫元素质量分数为0%;来分析解答.
解答 解:
在SO2中硫元素的质量分数为$\frac{32}{32+16×2}$×100%=50%,三氧化硫中的硫元素的质量分数=$\frac{32}{32+16×3}$×100%=40%,在O2中不含硫元素,即硫元素质量分数为0%;
若含有一种气体,应为SO3;
若是混合气体,要满足硫元素的质量分数为40%,若有SO2存在,则必须有不含硫元素的气体存在或硫元素的质量分数小于40%,即可能是SO2、O2或SO2、O2和SO3;
故答案为:①SO3;②SO2、O2;③SO2、O2和SO3.
点评 本题难度较大,在计算元素质量分数的基础上,利用平均值来分析其组成是解题的关键

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.下列说法中正确的是( )
| A. | 分解反应不可能生成化合物,只能生成单质 | |
| B. | 化合反应的生成物一定是化合物 | |
| C. | 矿泉水中含有多种不同的元素,所以矿泉水是化合物 | |
| D. | 混合物的组成中肯定含多种元素 |
20.2015年4月25日12时,尼泊尔中部地区突发7.9级(中国地震台网测定为8.1级)强烈地震.这场地震导致了珠穆朗玛峰的雪崩,珠峰南坡大本营被毁,多名中国登山人员被困,多人受伤.当时搜救人员克服严重的高原反应等困难,背着氧气瓶全力展开搜救,吸氧是克服高原反应的方法之一,吸氧可以帮助搜救人员克服高原反应的原因是( )
| A. | 氧气可以支持燃烧 | B. | 氧气可以燃烧 | ||
| C. | 氧气可供呼吸 | D. | 氧气是无色无味的气体 |
7.下列有关物质的组成、结构和性质关系叙述,不正确的是( )
| A. | 保持氧气化学性质的最小微粒是氧分子 | |
| B. | 分子可分,原子不可再分 | |
| C. | 元素的化学性质与原子最外层电子数目关系密 | |
| D. | 构成物质的微粒有分子、原子、离子 |
17.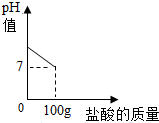 在含氯化钠杂质的碳酸钠13.6g中逐渐加入质量分数为7.3%稀盐酸,所加稀盐酸的质量与pH的关系如图所示:
在含氯化钠杂质的碳酸钠13.6g中逐渐加入质量分数为7.3%稀盐酸,所加稀盐酸的质量与pH的关系如图所示:
(1)100g稀盐酸中氯化氢的质量7.3g.
(2)完全反应后,所得溶液中溶质的质量分数?
 在含氯化钠杂质的碳酸钠13.6g中逐渐加入质量分数为7.3%稀盐酸,所加稀盐酸的质量与pH的关系如图所示:
在含氯化钠杂质的碳酸钠13.6g中逐渐加入质量分数为7.3%稀盐酸,所加稀盐酸的质量与pH的关系如图所示:(1)100g稀盐酸中氯化氢的质量7.3g.
(2)完全反应后,所得溶液中溶质的质量分数?
2.钛(Ti)是一种重要的航天金属材料,小明和小强在实验室探究它的金属活动性强弱.两人找到了质量相同并打磨光亮的镁、铝、铜、钛四种金属片,以及质量分数都为10%的稀硫酸和稀盐酸.
(1)两人分别设计了如下实验:
Ⅰ、小强先将镁片、钛片分别投入到200克质量分数为10%的稀盐酸中;将铝片、铜片分别投入到200克质量分数为10%的稀硫酸中.小强实验设计中欠妥之处是不在同一种酸的条件下进行实验.
Ⅱ、小明选择四块质量相同的金属片,分别投入到200克质量分数为10%的稀硫酸中.观察到的实验现象如下:
根据小明的实验现象指出四种金属的活动性由强到弱的顺序(用元素符号表示)Mg>Al>Ti>Cu.
(2)写出一个你所熟悉的并与该实验相关的化学方程式Mg+H2SO4=MgSO4+H2↑.
(3)结论应用能否用铝制品来盛装硫酸铜溶液、理由是:铝制容器能与硫酸铜溶液反应并置换出铜.
(1)两人分别设计了如下实验:
Ⅰ、小强先将镁片、钛片分别投入到200克质量分数为10%的稀盐酸中;将铝片、铜片分别投入到200克质量分数为10%的稀硫酸中.小强实验设计中欠妥之处是不在同一种酸的条件下进行实验.
Ⅱ、小明选择四块质量相同的金属片,分别投入到200克质量分数为10%的稀硫酸中.观察到的实验现象如下:
| 金属 | Ti | Mg | Al | Cu |
| 现象 | 有气泡产生, 但反应缓慢 | 大量气泡产生, 反应非常剧烈 | 有较多气泡产生, 反应较剧烈 | 无气泡产生, 无明显现象 |
(2)写出一个你所熟悉的并与该实验相关的化学方程式Mg+H2SO4=MgSO4+H2↑.
(3)结论应用能否用铝制品来盛装硫酸铜溶液、理由是:铝制容器能与硫酸铜溶液反应并置换出铜.
3.2015年6月烟台通过南水北调引入黄河水,缓解了我市的水危机.小红同学拟定了黄河水净化的操作流程,如图所示,有关说法错误的是( )


| A. | 步骤Ⅰ中加入的试剂X可以是明矾,以加速悬浮颗粒的沉降 | |
| B. | Y试剂可以是活性炭 | |
| C. | 高铁酸钾消毒杀菌发生了化学变化 | |
| D. | 得到的净化水是纯水 |
