题目内容
10.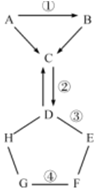 如图表示的是初中化学常见的物质A-H相互间的关系(“→”表示物质间的转化关系,“-”表示两端的物质能发生化学反应).A、G都是单质,气体C常用于灭火,D是一种可溶性盐,F是一种蓝色溶液,可用于配制农药波尔多液.请你回答:
如图表示的是初中化学常见的物质A-H相互间的关系(“→”表示物质间的转化关系,“-”表示两端的物质能发生化学反应).A、G都是单质,气体C常用于灭火,D是一种可溶性盐,F是一种蓝色溶液,可用于配制农药波尔多液.请你回答:(1)C的化学式CO2,H可能是盐酸;
(2)写出标号②、④的化学方程式:
②2NaOH+CO2═Na2CO3+H2O;
④Fe+CuSO4=FeSO4+Cu.
(3)E属于碱(填物质类别即:酸、碱、盐、单质、氧化物)
分析 根据给定的物质的性质以及给出的实验过程的实验现象分析和解答.
解答 解:由分析可知C是二氧化碳,F是硫酸铜溶液,又因为A、G都是单质,所以A是C,碳燃烧能生成一氧化碳,B是一氧化碳,一氧化碳燃烧能生成二氧化碳,所以B是一氧化碳符合要求,由F是硫酸铜溶液可推出G和E可以是金属或者是碱溶液,假设G是铁,E是氢氧化钙,H是酸假设是盐酸,由D既可以与酸反应,又可以与碱反应,推出D属于可溶性碱溶液,所以D是碳酸钠溶液,碳酸钠溶液可以与盐酸反应生成二氧化碳,二氧化碳也可以与氢氧化钠溶液反应生成碳酸钠溶液,故符合题意;
(1)C是二氧化碳,H是可能是盐酸,故填:CO2;盐酸;
(2)反应②可以是氢氧化钠和二氧化碳的反应,二者反应生成碳酸钠和水,故填:2NaOH+CO2═Na2CO3+H2O;
反应④是铁和硫酸铜反应生成硫酸亚铁和铜,故填:Fe+CuSO4=FeSO4+Cu;
(3)E是氢氧化钙,属于碱类物质,故填:碱.
点评 熟记常见物质的特性或者对应的特征性实验现象,是解答物质推断题的关键.然后找到解答的突破口,逐一分析.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
1.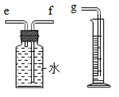 化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.
化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.
【提出问题】锌与稀硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】①可能与稀硫酸的溶质质量分数有关; ②可能与锌的形状有关.
【设计并实验】兴趣小组用100mL不同质量分数的稀硫酸和5g不同形状的锌进行如下实验(时间为3分钟).
(1)锌与硫酸反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑.
(2)如图所示装置收集并测量氢气的体积,则正确的链接顺序是:氢气→e f g(填导管口序号).
【收集证据】
(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是①③或②④.
【得出结论】依据上表得出的结论是相同条件下,硫酸的质量分数越大,反应速率越快或锌与硫酸的接触面积越大,反应速率越快.
【反思评价】
(4)下表是兴趣小组第①组实验根据前6分钟记录详细数据(每分钟记录一次产生氢气的体积).
请解释锌与稀硫酸反应由快变慢的原因随着硫酸被消耗,硫酸溶质质量分数变小,所以反应速度由快变慢.
(5)锌与硫酸反应的快慢可能还会受温度因素影响,如果用实验验证该因素对反应快慢的影响,应该控制温度因素不同,而其他因素则相同.
 化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.
化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.【提出问题】锌与稀硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】①可能与稀硫酸的溶质质量分数有关; ②可能与锌的形状有关.
【设计并实验】兴趣小组用100mL不同质量分数的稀硫酸和5g不同形状的锌进行如下实验(时间为3分钟).
| 编号 | 硫酸的质量分数 (均取20mL) | 锌的形状 (均取1g) | 氢气的体积(mL) (均收集3分钟) |
| 1 | 20% | 锌粒 | 31.7 |
| 2 | 20% | 锌片 | 50.9 |
| 3 | 30% | 锌粒 | 61.7 |
| 4 | 30% | 锌片 | 79.9 |
(2)如图所示装置收集并测量氢气的体积,则正确的链接顺序是:氢气→e f g(填导管口序号).
【收集证据】
(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是①③或②④.
【得出结论】依据上表得出的结论是相同条件下,硫酸的质量分数越大,反应速率越快或锌与硫酸的接触面积越大,反应速率越快.
【反思评价】
(4)下表是兴趣小组第①组实验根据前6分钟记录详细数据(每分钟记录一次产生氢气的体积).
| 时段 (均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积/mL | 3.1 | 16.7 | 11.9 | 9.6 | 7.6 | 6.0 |
(5)锌与硫酸反应的快慢可能还会受温度因素影响,如果用实验验证该因素对反应快慢的影响,应该控制温度因素不同,而其他因素则相同.
5.下列属于化学变化的是( )
| A. | 雪糕冒“白气” | B. | 钢铁生锈 | C. | 干冰升华 | D. | 铁块熔化 |
15.为达到实验目的,下列实验方案或结论正确的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 除去铁粉中含有的少量铜粉 | 将混合固体加入到足量稀盐酸中,充分反应后过滤、洗涤、干燥 |
| B | 鉴别①CuSO4溶液②稀H2SO4③NaCl溶液④NaOH溶液 | 不用其它任何试剂就能鉴别,且鉴别的顺序为①④②③或①④③② |
| C | 除去CO2中的少量HCl气体 | 先通过NaOH溶液,再通过浓硫酸 |
| D | 比较Fe、Cu、Al的金属活动性 | 铝丝浸入CuSO4溶液,铜丝浸入FeSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
2.下列化学方程式书写正确的是( )
| A. | Mg+O2$\frac{\underline{\;点燃\;}}{\;}$MgO2 | B. | 4Fe+3O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3 | ||
| C. | CO2+Ca(OH)2═CaCO3+H2O | D. | NH4HCO3$\frac{\underline{\;加热\;}}{\;}$NH3↑+CO2↑+H2O |
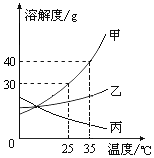 甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:
甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答: