题目内容
10.化学兴趣小组欲测量某石灰石样品中碳酸钙的纯度(假设其他成分既不和酸反应,也不溶于水),进行如下反应.请计算:
(1)10g石灰石样品中碳酸钙的质量.
(2)上述反应所得滤液中溶质的质量分数.(计算结果保留0.1%)
分析 碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳;
根据反应的化学方程式和提供的数据可以计算反应所得滤液中溶质的质量分数.
解答 解:(1)10g石灰石样品中碳酸钙的质量为:10g-2.0g=8.0g,
答:10g石灰石样品中碳酸钙的质量是8.0g.
(2)设反应生成氯化钙的质量为x,生成二氧化碳的质量为y,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 111 44
8.0g x y
$\frac{100}{8.0g}$=$\frac{111}{x}$=$\frac{44}{y}$,
x=8.88g,y=3.52g,
反应所得滤液中溶质氯化钙的质量分数为:$\frac{8.88g}{8.0g+100g-3.52g}$×100%=8.5%,
答:反应所得滤液中溶质氯化钙的质量分数为8.5%.
点评 计算溶液的质量时,要注意减去反应生成的二氧化碳的质量,否则会导致计算的结果偏小.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
15.下列离子在pH=1的溶液中能够大量共存的是( )
| A. | SO42-、Na+、K+、Cl- | B. | Ca2+、K+、Cl-、CO32- | ||
| C. | Fe2+、CO32-、K+、Cl- | D. | Al3+、Ag+、K+、Cl- |
2.以下是小明同学书写的部分化学用语,其中正确的是( )
①金刚石-C ②五氧化二磷-O5P2 ③氯化铁-FeCl3 ④钠元素显+1价-Na+1 ⑤两个铝离子-2Al3+.
①金刚石-C ②五氧化二磷-O5P2 ③氯化铁-FeCl3 ④钠元素显+1价-Na+1 ⑤两个铝离子-2Al3+.
| A. | ①②④ | B. | ①③⑤ | C. | ②③⑤ | D. | ②③④ |
19.下列关于水的说法正确的是( )
| A. | 所有物质都易溶于水 | |
| B. | 可将工业废水任意排入内河 | |
| C. | 生活中常用肥皂水检验软水和硬水 | |
| D. | 水电解过程与电源正极连接的一端产生氢气 |
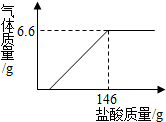 现将19.9g含氢氧化钠的碳酸钠固体中加入100g水充分溶解,向该溶液中逐滴加入一定溶质质量分数的盐酸,生成气体的质量与加入盐酸的质量关系如图所示.请计算
现将19.9g含氢氧化钠的碳酸钠固体中加入100g水充分溶解,向该溶液中逐滴加入一定溶质质量分数的盐酸,生成气体的质量与加入盐酸的质量关系如图所示.请计算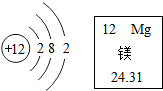 农作物必需的营养元素有碳、氢、氧、氮、磷、钾、钙、镁等.
农作物必需的营养元素有碳、氢、氧、氮、磷、钾、钙、镁等.