题目内容
14.将6.5g锌放入盛有93.7g稀硫酸溶液的烧杯中,恰好完全反应后,称得烧杯内的物质的总质量为100g.请计算:(1)生成氢气的质量是0.2g.
(2)反应后所得溶液中溶质的质量分数是多少?
分析 根据题中的叙述列出化学方程式,再依据所给数据和设出的数据找出比例关系进行解答,最后将解出的答案进行总结即可.6.5是纯锌的质量,而93.7是溶液的质量,所以可以直接使用6.5,而不可以用93.7带入化学方程式计算.
解答 解:设可产生氢气的质量为x,生成的ZnSO4的质量为y
Zn+H2SO4=ZnSO4+H2↑
65 161 2
6.5g y x
$\frac{65}{6.5g}=\frac{161}{y}=\frac{2}{x}$
x=0.2g,y=16.1g
溶液中溶质的质量分数为:$\frac{16.1g}{6.5g+93.7g-0.2g}×100%$=16.1%
答:氢气的质量是0.2克,溶液中溶质的质量分数为16.1%.
点评 在解此类题时,首先书写化学方程式,然后在列出比例关系解答相关数据,最后进行总结即可.

练习册系列答案
相关题目
5.下列变化中属于物理变化的是( )
| A. | 燃放烟花 | B. | 冰雪被融化 | ||
| C. | 用食醋除去水壶中的水垢 | D. | 用酒精炉加热食物 |
2.下列各组物质的溶液不用其它试剂就可鉴别的是( )
| A. | HCl CuSO4 KNO3 Na2SO4 | B. | FeCl3 HCl NaCl NaOH | ||
| C. | CaCl2 K2CO3 HCl Na2CO3 | D. | NaNO3 Na2SO4 HCl H2SO4 |
19.下列说法正确的是( )
| A. | 硬水洗涤衣物适宜使用肥皂 | |
| B. | 二氧化锰可作所有反应的催化剂 | |
| C. | 吸入甲醛或一氧化碳会危害人体健康 | |
| D. | 铝合金与钢铁相比具有密度大、易腐蚀的特点 |
15.下列不能做酸碱指示剂的花是( )
| 指示剂 (花汁) | 在不同溶液中的颜色变化 | ||||
| 盐酸 | 酒精溶液 | 氢氧化钠溶液 | 石灰水 | ||
| A | 红玫瑰 | 粉红色 | 粉红色 | 绿色 | 绿色 |
| B | 万寿菊 | 黄色 | 黄色 | 黄色 | 黄色 |
| C | 月季花 | 浅红色 | 红色 | 黄色 | 黄色 |
| D | 丝瓜花 | 红色 | 红色 | 黄绿色 | 黄绿色 |
| A. | A | B. | B | C. | C | D. | D |

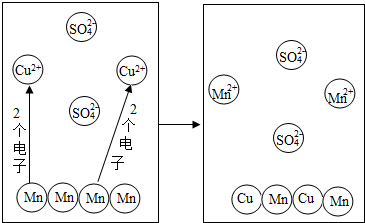 从微观的角度了解物质及其变化,有助于更好的认识物质组成和变化的本质.
从微观的角度了解物质及其变化,有助于更好的认识物质组成和变化的本质.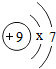 ,则x=2,在化学反应中氟原子易得到(填“得到”或“失去“)电子.
,则x=2,在化学反应中氟原子易得到(填“得到”或“失去“)电子.