题目内容
14.已知不溶于水的碱受热分解成碱性氧化物和水,现有M、N、P三种不同金属,A、B、C、D、E、F是含它们其中某种元素的化合物且它们发生如下的转化关系:
由此推断:
(1)溶液A中的溶质为FeSO4写化学式;
(2)写出下列物质的化学式CFe2(SO4)3.ECuSO4;
(3)M、N、P三种金属的活动性由强到弱的顺序是P、N、M;
(4)写出B物质和W酸反应的化学方程式3H2SO4+Fe2O3=Fe2(SO4)3+3H2O;
(5)写出F物质转化为D物质的化学方程式Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O.
分析 根据题目中的信息“M、N、P三种不同金属,结合图框,其中一个突破口为“E为蓝色溶液得出蓝色沉淀”,则推测D为氧化铜,则M为铜,E为硫酸铜溶液,F为氢氧化铜沉淀;另一个突破口是“红褐色沉淀”,则推测沉淀为氢氧化铁,则B为氧化铁,则推测N为铁,B为氧化铁;A、B、C、D、E、F是含它们其中某种元素的化合物”,则W为稀硫酸,A溶液为硫酸亚铁溶液;P则为活动性大于铁的金属,如锌或镁等,据此分析完成相关的问题.
解答 解:“M、N、P三种不同金属,结合图框,其中一个突破口为“E为蓝色溶液得出蓝色沉淀”,则推测D为氧化铜,则M为铜,E为硫酸铜溶液,F为氢氧化铜沉淀;另一个突破口是“红褐色沉淀”,则推测沉淀为氢氧化铁,则B为氧化铁,则推测N为铁,B为氧化铁;A、B、C、D、E、F是含它们其中某种元素的化合物”,则W为稀硫酸,A溶液为硫酸亚铁溶液;P则为活动性大于铁的金属,如锌或镁等,带入验证符合转化关系,因此:
(1)溶液A中的溶质是硫酸亚铁;故填:FeSO4;
(2)C为氧化铁和硫酸反应产生的硫酸铁,E为氧化铜和硫酸反应产生的硫酸铜;故填:Fe2(SO4)3;CuSO4;
(3)P可以把M、N置换出来,N能够和酸反应,M不能,因此P的活动性比N强,N比M强;故填:P、N、M;
(4)氧化铁和硫酸反应产生的硫酸铁和水;故填:3H2SO4+Fe2O3=Fe2(SO4)3+3H2O;
(5)根据信息氢氧化铜加热分解产生氧化铜和水,故填:Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O.
点评 本题为框图式物质推断题,完成此题,可以依据题干提供的信息,直接得出有关物质的化学式,然后顺推或逆推得出其他物质的化学式.需要同学们熟练掌握常见物质的性质,以便灵活应用.

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案| A. | 海水晒盐 | B. | 风力发电 | ||
| C. | 太阳能取暖 | D. | 煅烧石灰石制生石灰 |
(1)如图1所示,反应后溶液(编号为 a)中溶质的组成情况可能有3种.
为证明溶液 a 中可能含有的溶质,进行了如下实验:
①确定溶液 a 中是否含有氢氧化钠
| 步骤 | 现象 | 结论 |
| 取少量溶液a,滴加氯化铜溶液 | 溶液中无蓝色絮状沉淀 | 不含氢氧化钠 |
| 方案 | 步骤 | 现象 |
| 一 | 取少量溶液a,滴加硝酸银溶液 | 产生白色沉淀 |
| 二 | 取少量溶液a,加入镁粉 | 产生气泡 |
ii.采取正确的实验方案,进行实验,根据现象得到的结论是溶液中含有稀盐酸,且溶质是氯化钠和氯化氢;ⅲ.欲从溶液a中得到纯净的氯化钠,可以采取的实验操作是蒸发结晶.
(2)利用如图2装置验证氢氧化钠能与二氧化碳反应.(装置气密性良好)
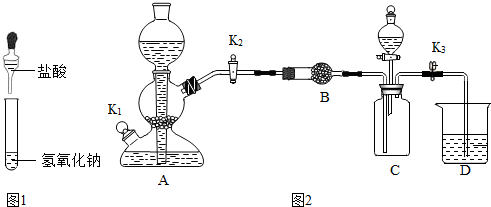
①装置A用于制取二氧化碳,打开K2、K3,当D中紫色石蕊试液变红色,可确定C中收集满二氧化碳.
②甲同学打开装置 C 中分液漏斗活塞,将 8mL 室温时氢氧化钠饱和溶液滴入 C 中,然后关闭活塞,观察到 D 中石蕊试液倒流至 C 中.甲同学得出结论,氢氧化钠能与二氧化碳反应.
③乙同学认为上述现象不足以证明氢氧化钠能与二氧化碳发生反应,还应利用上述装置补充一个对比实验.
| 液体 | 步骤 | 现象 |
| 水 | 打开分液漏斗活塞,加入液体后关闭活塞 | D中导管先有气泡冒出,后D中石蕊试液倒流较少或D中导管倒吸一段水柱 |
 实验室用高锰酸钾在如图所示装置中制取氧气,有关说法正确的是( )
实验室用高锰酸钾在如图所示装置中制取氧气,有关说法正确的是( )| A. | 装好高锰酸钾后,应检查装置的气密性 | |
| B. | 将集气瓶装满水,然后倒立于水槽内收集纯净的氧气 | |
| C. | 加热时,应将酒精灯的外焰一直集中在试管底部 | |
| D. | 待导管口产生连续并比较均匀的气泡时才开始收集氧气 |
 下列关于三聚氰胺(如图所示)的说法错误的是( )
下列关于三聚氰胺(如图所示)的说法错误的是( )| A. | 三聚氰胺的分子式为C3N6H6 | |
| B. | 三聚氰胺中氮元素的质量分数约为27.45% | |
| C. | 三聚氰胺分子中每个碳原子周围均有3个氮原子 | |
| D. | 三聚氰胺确实可以提高奶粉的蛋白质含量,只不过由于会导致肾结石才被禁止添加 |
