题目内容
11.如图是某同学设计的实验室制取氧气的实验装置图,请回答下列问题:
(1)分液漏斗的优点:能够控制反应速率,节约药品
(2)二氧化锰在该化学反应中的作用是催化作用
(3)组装好A装置后,该同学先向分液漏斗中加入水,然后将导管另一端浸入水中,并打开分液漏斗的活塞,观察导管口是否有连续的气泡冒出,该操作的目的是检验装置的气密性.
(4)A装置中发生反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,氧气能用B图收集的原因是氧气不易溶于水,应将收集满氧气的集气瓶正放在桌面上.
分析 (1)分液漏斗能够控制液体药品的用量,从而可以控制反应的速率,同时可以节约液体药品;
(2)从二氧化锰在反应前后质量和化学性质都没有改变,只是加快了过氧化氢反应生成氧气的速率去分析解答;
(3)从组装好A装置后,要先检查装置的气密性,防止由于漏气而收集不到制取的气体,造成药品的浪费去分析解答;
(4)据过氧化氢制取氧气的原理,从氧气不易溶于水去分析解答;从氧气的密度比空气大去分析解答.
解答 解:(1)分液漏斗能够控制液体药品的用量,从而可以控制反应的速率,同时可以节约液体药品;
(2)过氧化氢溶液在二氧化锰催化作用下生成水和氧气,二氧化锰在反应前后质量和化学性质都没有改变,只是加快了过氧化氢反应生成氧气的速率,故二氧化锰是催化剂;
(3)组装好A装置后,要先检查装置的气密性,防止由于漏气而收集不到制取的气体,造成药品的浪费,所以该同学先向分液漏斗中加入水,然后将导管一端通入水中,并打开分液漏斗的活塞,观察导管口是否有连续的气泡冒出,该操作的目的是检查装置的气密性;故答案为:检查装置的气密性;
(4)A装置中发生反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
由于氧气不易溶于水,所以可用排水法收集;由于氧气的密度比空气大,所以收集满氧气的氧气瓶应正放在桌面上;
故答案为:(1)能够控制反应速率,节约药品;(2)催化作用;(3)检验装置的气密性;(4)2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑、氧气不易溶于水、正.
点评 题主要考查实验室制取二氧化碳、氧气的药品选择、装置设计、文字表达式的书写等方面的知识,综合性较强,需要多方面的知识才能正确解答.

练习册系列答案
相关题目
1.某学生测定的下列数据中,不合理的是( )
| A. | 用10ml量筒量取了7.5ml水 | |
| B. | 用托盘天平称的某小苏打样品的质量为16.7g | |
| C. | 用PH试纸测得某地水的PH为5.2 | |
| D. | 测得某粗盐中氯化钠的质量分数为90.5% |
6. 在实验探究课上,老师给了同学们一包红色粉末,该粉末是铜粉和氧化铁(Fe2O3)粉末中的一种或两种.
在实验探究课上,老师给了同学们一包红色粉末,该粉末是铜粉和氧化铁(Fe2O3)粉末中的一种或两种.
同学们为了确定该粉末的成分,进行如下探究.请你参与他们的探究活动并回答问题.
(1)[提出问题]假设1:红色粉末是铜粉;假设2:红色粉末是氧化铁粉;
假设3:红色粉末是铜粉和氧化铁粉的混合物.
(2)[设计实验方案]同学们为了验证上述假设,设计了如图所示实验装置,并对实验结果作了如下设想和分析:取少量红色粉末放人硬质玻璃管中,通入一氧化碳,片刻后加热至充分反应.
请你完成下表:
(3)[进行实验]通过实验,确认假设3成立.
(4)[反思与评价]
①实验过程中,硬质玻璃管内发生反应的化学方程式是:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
②实验时,先通入一氧化碳片刻后再加热的原因是:防止加热时硬质玻璃管发生爆炸.
③从环保角度看,上面的实验装置有不足之处,请你对该装置进行改进,具体措施是在b处用酒精灯点燃.
 在实验探究课上,老师给了同学们一包红色粉末,该粉末是铜粉和氧化铁(Fe2O3)粉末中的一种或两种.
在实验探究课上,老师给了同学们一包红色粉末,该粉末是铜粉和氧化铁(Fe2O3)粉末中的一种或两种.同学们为了确定该粉末的成分,进行如下探究.请你参与他们的探究活动并回答问题.
(1)[提出问题]假设1:红色粉末是铜粉;假设2:红色粉末是氧化铁粉;
假设3:红色粉末是铜粉和氧化铁粉的混合物.
(2)[设计实验方案]同学们为了验证上述假设,设计了如图所示实验装置,并对实验结果作了如下设想和分析:取少量红色粉末放人硬质玻璃管中,通入一氧化碳,片刻后加热至充分反应.
请你完成下表:
| 实验中可能出现的现象 | 结论 |
| 则假设1成立 | |
| 则假设2成立 | |
| 则假设3成立 |
(4)[反思与评价]
①实验过程中,硬质玻璃管内发生反应的化学方程式是:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
②实验时,先通入一氧化碳片刻后再加热的原因是:防止加热时硬质玻璃管发生爆炸.
③从环保角度看,上面的实验装置有不足之处,请你对该装置进行改进,具体措施是在b处用酒精灯点燃.
3.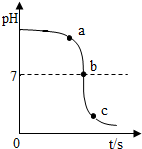 某校化学小组在利用稀硫酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图象,如图所示,下列说法正确的是( )
某校化学小组在利用稀硫酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图象,如图所示,下列说法正确的是( )
 某校化学小组在利用稀硫酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图象,如图所示,下列说法正确的是( )
某校化学小组在利用稀硫酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图象,如图所示,下列说法正确的是( )| A. | 图中c点所示溶液呈碱性 | |
| B. | 图中a点所示溶液中,含有的溶质是Na2SO4和H2SO4 | |
| C. | 若将实验中的稀硫酸改为其溶质质量分数相同的稀盐酸,恰好完全反应时消耗稀盐酸质量小于稀硫酸 | |
| D. | 由a点到b点的pH变化过程证明酸和碱发生了中和反应 |
20.同学们对制作糕点常用膨松剂Na2CO3或NaHCO3进行了下列探究.
【查阅资料】
【探究一】NaHCO3和Na2CO3性质差异的探究
(1)现有20℃时溶质质量分数为8%的Na2CO3和NaHCO3溶液
酸碱性:取样于试管中,分别滴加紫色石蕊试液,均显蓝色;
酸碱度:NaHCO3溶液<Na2CO3溶液(填“>”或”“<”).
(2)稳定性:按图1,实验中可观察乙烧杯中的石灰水变浑浊,
甲烧杯不变,则乙烧杯中发生反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O.
结论:在受热条件下,碳酸钠比碳酸氢钠稳定性强(填“强”或“弱”).
(3)利用溶解度鉴别NaHCO3和Na2CO3:分别取Xg两种固体粉末加入20℃,10g水中充分溶解,通过观察溶解现象来区分,X可以是下列的A.(选填A、B或C)
A.1.5g B.0.96g C.0.5g
【探究二】测定NaHCO3和Na2CO3混合物10.0g中NaHCO3的质量分数(图2,夹持装置略)

【问题讨论】
(4)实验前先通一段时间的空气的目的是排尽装置内的空气(或二氧化碳);
(5)A的作用是吸收鼓入空气中的二氧化碳,若没有装置E,NaHCO3的质量分数测定结果会偏大(填“偏大”、“不变”或“偏小”).
(6)停止加热后,仍继续通入空气一段时间,目的是使反应生成的二氧化碳全部被D吸收.
【含量测定】
(7)测得装置D的质量实验前为120.2g,实验后为122.4g,计算该样品中NaHCO3的质量分数.(要有计算过程)
【知识拓展】
(8)向Na2CO3溶液中通入CO2气体可以生成NaHCO3,该反应的化学反应方程式为:Na2CO3+CO2+H2O═2NaHCO3.
【查阅资料】
| 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
(1)现有20℃时溶质质量分数为8%的Na2CO3和NaHCO3溶液
酸碱性:取样于试管中,分别滴加紫色石蕊试液,均显蓝色;
酸碱度:NaHCO3溶液<Na2CO3溶液(填“>”或”“<”).
(2)稳定性:按图1,实验中可观察乙烧杯中的石灰水变浑浊,
甲烧杯不变,则乙烧杯中发生反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O.
结论:在受热条件下,碳酸钠比碳酸氢钠稳定性强(填“强”或“弱”).
(3)利用溶解度鉴别NaHCO3和Na2CO3:分别取Xg两种固体粉末加入20℃,10g水中充分溶解,通过观察溶解现象来区分,X可以是下列的A.(选填A、B或C)
A.1.5g B.0.96g C.0.5g
【探究二】测定NaHCO3和Na2CO3混合物10.0g中NaHCO3的质量分数(图2,夹持装置略)

【问题讨论】
(4)实验前先通一段时间的空气的目的是排尽装置内的空气(或二氧化碳);
(5)A的作用是吸收鼓入空气中的二氧化碳,若没有装置E,NaHCO3的质量分数测定结果会偏大(填“偏大”、“不变”或“偏小”).
(6)停止加热后,仍继续通入空气一段时间,目的是使反应生成的二氧化碳全部被D吸收.
【含量测定】
(7)测得装置D的质量实验前为120.2g,实验后为122.4g,计算该样品中NaHCO3的质量分数.(要有计算过程)
【知识拓展】
(8)向Na2CO3溶液中通入CO2气体可以生成NaHCO3,该反应的化学反应方程式为:Na2CO3+CO2+H2O═2NaHCO3.
 为验证“酸的化学性质”,某班同学在实验室进行如图实验,请分析并回答相关问题:
为验证“酸的化学性质”,某班同学在实验室进行如图实验,请分析并回答相关问题: