题目内容
11. 用质量分数为5%的稀盐酸和10%的氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图所示:
用质量分数为5%的稀盐酸和10%的氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图所示:(1)该实验是将氢氧化钠溶液(选填“稀盐酸”或“氢氧化钠溶液”)滴加到另一种溶液中.
(2)当加入溶液的质量为b时.此时溶液中的溶质是NaCl、NaOH(填化学式).
(3)当加入溶液的质量a为20g时.求所得溶液中溶质的质量.
分析 稀盐酸和氢氧化钠反应生成氯化钠和水,根据反应的化学方程式可以进行相关方面的计算和判断.
解答 解:(1)随着反应进行,溶液pH增大,说明该实验是将氢氧化钠溶液滴加到另一种溶液中.
故填:氢氧化钠溶液.
(2)当加入溶液的质量为b时氢氧化钠过量,此时溶液中的溶质是NaCl、NaOH.
故填:NaCl、NaOH.
(3)当加入溶液的质量a为20g时,稀盐酸和氢氧化钠恰好完全反应,设所得溶液中溶质氯化钠的质量为x,
NaOH+HCl═NaCl+H2O,
40 58.5
20g×10% x
$\frac{40}{20g×10%}$=$\frac{58.5}{x}$,
x=2.925g,
答:所得溶液中溶质氯化钠的质量为2.925g.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
1.下列所示的图象能反映相对应实验的是( )
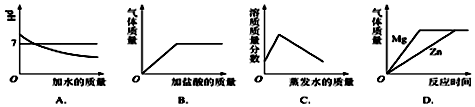

| A. | 向pH=12的石灰水中不断加水稀释 | |
| B. | 向碳酸钙固体中逐滴加入稀盐酸至过量 | |
| C. | 在40℃,将饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出 | |
| D. | 将等质量的金属镁和锌分别和足量相同质量分数的稀硫酸混合 |
16.某混合气体可能含有CO、CO2、H2和H2O(气)中的一种或几种.为验证其组成,同学们进行实验的装置和现象如下(夹持仪器已省略,假设气体均吸收完全).

(1)仪器a的名称是锥形瓶.
(2)装置D中溶液变浑浊的化学方程式是CO2+Ca(OH)2=CaCO3↓+H2O.
(3)丁认为,由于他们对装置A中的实验现象分析不同而导致结论有差异.根据碳酸盐可转变为CO2的性质,丁利用上述实验结束后装置内药品和某种常见试剂进行实验,证明了甲的结论是正确的.请写出丁的实验操作过程与现象.

| 结论 | 甲 | 乙 | 丙 |
| 含有CO、H2、H2O(气) | 含有CO、H2、CO2 | 含有C0、H2、C02、H20(气) |
(2)装置D中溶液变浑浊的化学方程式是CO2+Ca(OH)2=CaCO3↓+H2O.
(3)丁认为,由于他们对装置A中的实验现象分析不同而导致结论有差异.根据碳酸盐可转变为CO2的性质,丁利用上述实验结束后装置内药品和某种常见试剂进行实验,证明了甲的结论是正确的.请写出丁的实验操作过程与现象.
