题目内容
某兴趣小组对“蜡烛燃烧的产物”进行探究。
【查阅资料】蜡烛的主要成分是石蜡,石蜡由碳、氢两种元素组成。
【作出猜想】蜡烛燃烧的产物是二氧化碳和水。
【实验验证】(1)用干冷的小烧杯罩在蜡烛火焰上,观察到 ,证明有水生成。
(2)用涂有饱和石灰水的小烧杯罩在火焰上,石灰水变浑浊,证明有二氧化碳生成,二氧化碳和石灰水反应的化学方程式为 。
小明提出质疑:石灰水变浑浊不一定是生成了碳酸钙,还可能是饱和石灰水受热后 ,析出了氢氧化钙。
同学们又用图20所示的装置进行实验,1分钟后,提起锥形瓶,翻转后注入20mL饱和石灰水,加塞、振荡,观察到石灰水变浑浊,确定有二氧化碳生成。

实验中小明观察到一个意外现象:锥形瓶内壁上有少量黑色物质。
【交流讨论】经分析,同学们一致认为是石蜡不充分燃烧生成的 。由此他们猜想还可能生成一氧化碳。
为验证一氧化碳,他们设计了如图21所示的实验。

【实验验证】(1)实验前,先在玻璃管的中部放入一团棉花,其目的是 。
(2)用酒精灯加热b端的糊状物,一段时间后,观察到黑色物质变成红色,证明蜡烛部充分燃烧有一氧化碳生成。
(4)为防止玻璃管中的红色物质又被氧化成黑色,接下来的操作是: 。
【拓展应用】含碳燃料不充分燃烧会生成一氧化碳等物质,浪费资源,且污染空气。为使其充分燃烧,应采取的措施是 。
【答案】【实验验证】(1)内壁有水雾(2)CO2 + Ca(OH)2 = CaCO3↓+ H2O 氢氧化钙的溶解度减小(或水蒸发)【交流讨论】炭黑(碳单质、碳、炭、C)
【实验验证】(1)阻挡炭黑,防止炭黑与氧化铜发生反应(4)先撤酒精灯,稍后撤蜡烛
【拓展应用】提供充足的空(氧)气(或增大燃料与氧气的接触面积)(答一条即可)。(除化学方程式外,答案不唯一,合理即可)
【解析】实验验证蜡烛燃烧产物是二氧化碳和水这一结论时,由于此反应放热,因此产生的水以气体的形式存在,因此用冷而干燥的烧杯罩在火焰上方,若出现水珠,说明有水生成。而检验二氧化碳的生成采用通入澄清石灰水的方法,选择用饱和石灰水,结合此反应放热,而熟石灰的溶解度随温度的升高而减小,由此提出质疑,饱和石灰水受热后溶解度减小从而析出氢氧化钙。而利用图20设计的实验目的是用锥形瓶收集产物二氧化碳气体,同 时水不仅起到液封作用,还起到了冷却降温的效果,避免温度对实验的影响。 针对锥形瓶内壁有少量黑色物质的讨论,可能是石蜡不充分燃烧的产物炭黑,进而猜想还可能生成一氧化碳,设计图21的实验验证时,为了阻挡生成的炭黑(主要成分是C)与CuO反应影响对CO的验证,在玻璃管中端放一些棉花。为了防止生成的铜在高温下重新被氧化,因此实验操作顺序很重要,若先熄灭蜡烛,停止产生CO,空气会在b处迅速与高温的铜发生反应生成CuO,导致实验失败,因此,实验结束时要停止酒精灯加热,继续点燃蜡烛,直至b端导管冷却至室温再撤离。要使可燃物燃烧充分,就要有充足的氧气,避免不充分燃烧产生CO等污染物对环境的影响。
时水不仅起到液封作用,还起到了冷却降温的效果,避免温度对实验的影响。 针对锥形瓶内壁有少量黑色物质的讨论,可能是石蜡不充分燃烧的产物炭黑,进而猜想还可能生成一氧化碳,设计图21的实验验证时,为了阻挡生成的炭黑(主要成分是C)与CuO反应影响对CO的验证,在玻璃管中端放一些棉花。为了防止生成的铜在高温下重新被氧化,因此实验操作顺序很重要,若先熄灭蜡烛,停止产生CO,空气会在b处迅速与高温的铜发生反应生成CuO,导致实验失败,因此,实验结束时要停止酒精灯加热,继续点燃蜡烛,直至b端导管冷却至室温再撤离。要使可燃物燃烧充分,就要有充足的氧气,避免不充分燃烧产生CO等污染物对环境的影响。

下列对一些事实的解释错误的是( )
| 事实 | 解释 | |
| A | 书写档案规定必须使用碳素墨水 | 碳的化学性质稳定 |
| B | 石墨能够做电池的电极材料 | 石墨能够导电 |
| C | 焦炭可以把铁从它的氧化物矿石里还原出来 | 焦炭具有氧化性 |
| D | 制糖工业中用活性炭来脱色以制白糖 | 活性炭具有吸附性 |
某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验,向烧杯中的氢氧化钙溶液滴加一定量的稀盐酸后,发现忘记滴加指示剂,此时,他们停止滴加稀盐酸,并对烧杯内溶液中溶质的成分进行探究。
(1)写出该中和反应的化学方程式_______________________。
(2)探究烧杯内溶液中溶质的成分:
【作出猜想】
(A)溶质可能是CaCl2与Ca(OH)2
(B)溶质可能是CaCl2
(C)溶质可能是CaCl2与HCl
【查阅资料】CaCl2溶液呈中性
【实验设计】
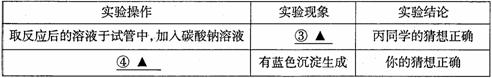
①取少量烧杯中的溶液于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色。于是排除了猜想(A),你认为排除猜想(A)的理由是_____________。
②小华想用碳酸钠溶液来验证后两种猜想,请你帮他完成实验,填写以下表格:
| 实验步骤 | 预计现象 | 预计结论 |
| 取少量反应后的溶液于试管中, 逐滴加入碳酸钠溶液 | 猜想(B)正确 | |
| 猜想(C)正确 |
【交流反思】
为确定猜想(C)正确,下列几种实验方案不合理的是__________(填字母)。
A.取反应后的溶液于试管中,滴加紫色石蕊试液变红色
B.取反应后的溶液于试管中,加入锌粉冒气泡
C.用洁净的玻璃棒蘸取反应后的溶液,涂抹在pH试纸上,测溶液的pH <7
D.取反应后的溶液于试管中,加入硝酸银溶液,生成白色沉淀
地球上的金属资源广泛地存在于地壳和海洋中,工业上主要是从含有金属元素并有开采价值的矿石中提炼金属。
(1)赤铁矿在自然界中储藏丰富,其主要成分的化学式是 。
(2)磁铁矿的主要成分是Fe3O4。在Fe3O4中存在两种不同价态的铁离子,其中1/3是Fe2+,2/3是Fe3+。请写出Fe3O4与盐酸反应的化学方程式 。
(3)工业上主要采用高炉炼铁,常用到的原料有铁矿石、焦炭、石灰石和空气。其中,焦炭的作用是 。(仅答一点)
(4)由于铁的氧化物中Fe3O4和FeO均为黑色,实验室用CO还原Fe2O3得到的铁中是否会含有Fe3O4和FeO,某同学设计了下列探究实验。
资料:FeCl3溶液与铁发生的反应是2FeCl3+Fe=3FeCl2,但FeCl3溶液不与Fe3O4和FeO反应;含有Fe3+的盐溶液遇到KSCN溶液时变成红色,利用该反应可检验的Fe3+存在。
【提出问题】CO还原Fe2O3得到黑色产物的成分是什么?
【猜想】
猜想1:Fe; 猜想2:Fe和Fe3O4; 猜想3:Fe和FeO; 猜想4: 。
【实验探究】限选试剂:CO、盐酸、澄清石灰水、KSCN溶液、FeCl3溶液。
| 实验操作 | 实验现象 | 实验结论 |
| I取少量黑色产物加入到装有足量FeCl3溶液的烧杯中,充分反应后过滤,对过滤所得固体用蒸馏水洗涤。 | 黑色固体部分溶解。 | 猜想2和4都不成立 |
| Ⅱ ① 。 | 黑色固体全部溶解,溶液不变红色。 | |
| Ⅲ另取少量黑色产物装入玻璃管中,通入CO,一段时间后加热,并将反应后的气体通入装有一定量的 ② 的烧杯中。 | ③ 。 | 猜想1不成立,猜想3成立。 |
(1)小明所在的化学兴趣小组需 配制溶质质量分数为6%的氯化钠溶液80g以备实验
配制溶质质量分数为6%的氯化钠溶液80g以备实验
①需要氯化钠的质量为 g;
②配制该溶液时所需要的玻璃仪器有烧杯、玻璃棒、胶头滴管和 ;
③经检测配制的溶液的溶质质量分数偏大,可能的原因是 (填字母序号)
A.称量时,砝码端忘记垫质量相同的纸片
B.取水时,俯视读数
C.装瓶时,有少量溶液洒出
(2)装瓶后,小明忘记及时贴上标签,以致和一瓶脱落标签的稀盐酸溶液混淆了。为了区分开来,请你帮助他完成相关实验设计:
I.化学方法:在不选用酸碱指示剂、pH试纸的情况下,选择物质种类不同的试剂区分
(物质类别是指单质、氧化物、酸、碱、盐等)。
| 所选试剂 | 实验现象及结论 | |
| 方法一 | ||
| 方法二 |
II.物理方法:小明同学仅使用了酒精灯和玻璃棒两种仪器,就把这两种无色溶液区分开来了。请你猜测一下他的做法(简要叙述操作方法及判断方法) 。


 具有 的性质,还说明二氧化碳气体 、
具有 的性质,还说明二氧化碳气体 、