题目内容
19.下列实验操作能达到实验目的是( )| 选项 | 实验目的 | 实验操作 |
| A | 除去混入氧气中的氮气 | 通过炽热的铜网 |
| B | 检验二氧化碳中含有少量的一氧化碳 | 点燃 |
| C | 除去木炭粉中的氧化铜 | 在空气中灼烧 |
| D | 除去FeSO4溶液中的CuSO4 | 加入足量铁粉,过滤 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
B、根据二氧化碳不能燃烧、不能支持燃烧,进行分析判断.
C、除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
D、除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答 解:A、氧气能与炽热的铜网反应生成氧化铜,氮气不与铜反应,反而会把原物质除去,不符合除杂原则,故选项实验操作不能达到实验目的.
B、二氧化碳不能燃烧、不能支持燃烧,二氧化碳(不能燃烧、不能支持燃烧)大量存在时,少量的一氧化碳是不会燃烧的,故选项实验操作不能达到实验目的.
C、木炭粉在空气中灼烧生成二氧化碳气体,反而会把原物质除去,不符合除杂原则,故选项实验操作不能达到实验目的.
D、足量铁粉能与硫酸铜溶液反应生成硫酸亚铁溶液和铜,再过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故选项实验操作能达到实验目的.
故选:D.
点评 本题难度不是很大,化学实验方案的设计是考查学生能力的主要类型,同时也是实验教与学难点,在具体设计时要对其原理透彻理解,可根据物质的物理性质和化学性质结合实验目的进行分析判断.

练习册系列答案
相关题目
9.在一个密闭容器中放入X、Y、Z、W四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如表.则关于此反应的说法正确的是( )
| 物 质 | X | Y | Z | W |
| 反应前的质量(g) | 2 | 1 | 16 | 16 |
| 反应后的质量(g) | 12 | m | 8 | 14 |
| A. | 物质Y一定是该反应的催化剂 | |
| B. | 该反应的基本类型为分解反应 | |
| C. | 反应生成X的质量为12 g | |
| D. | 该反应中Z和W两种物质变化的质量比为4:1 |
10.在一个密闭容器里有X、Y、Z、Q四种物质,在一定条件下充分反应,测得反应前后各物质的质量如表:
下列说法中,错误的是( )
| 物质 | X | Y | Z | Q |
| 反应前质量/g | 4 | 10 | 1 | 25 |
| 反应后质量/g | 待测 | 21 | 6 | 9 |
| A. | 该反应为化合反应 | B. | 该反应遵循质量守恒定律 | ||
| C. | X中待测值为4 | D. | 该反应中X可能是催化剂 |
14.根据你的生活经验和所学的化学知识判断,下列做法不科学的是( )
| A. | 用钢丝球洗刷铝制炊具 | B. | 用肥皂水区分硬水和软水 | ||
| C. | 用锅盖盖灭已着火的油锅 | D. | 用抹布擦干用过的菜刀防生锈 |
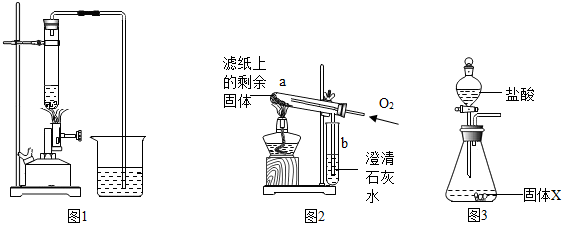
4.研究小组进行木炭还原氧化铁的探究活动.将木炭、氧化铁及试管充分烘干,并将木炭和氧化铁混合均匀、研磨.取适量上述混合物于试管中,用右图1所示的装置加热(试管竖直向上,可使加热时的热量尽少散失).
【提出问题】实验结束后,试管中的剩余固体X含有哪些成分,质量分别是多少?
【查阅资料】
铁的氧化物被还原时,是从高价铁的氧化物逐级还原成低价铁的氧化物,最后还原成金属铁.铁的部分氧化物的性质如下:
Fe3O4具有很好的磁性,能被磁铁吸引.铁的三种氧化物均不溶于水,但能溶于稀盐酸,分别发生如下反应:
Fe2O3+6HCl══2FeCl3+3H2O
Fe3O4+8HCl══2FeCl3+FeCl2+4H2O
FeO+2HCl══FeCl2+H2O
黄色的FeCl3溶液中滴入无色的KSCN溶液,溶液变为红色,该实验常用于检验FeCl3;FeCl3溶液遇单质铁发生反应:2FeCl3+Fe=3FeCl2,溶液变为浅绿色.
【猜想】固体X可能含有:①Fe ②FeO ③Fe3O4 ④Fe2O3(写化学式) ⑤C
【实施实验】
目的:确定固体X的组成.
【反思改进】
同学们讨论发现,用上述实验方法不能确定固体X中一定没有Fe3O4,理由是固体X中如果含有Fe3O4,步骤V中加盐酸后,由于铁与FeCl3反应生成FeCl2,遇KSCN溶液也不变血红色.
为确定固体X中是否含Fe3O4并测定其中各成分的质量,同学们又进行了以下实验:
【获得结论】
(1)为确定固体X中是否含Fe3O4,m1~m4中应该用到的数据有m1、m2、m3和m4.
(2)固体X各成分的质量比为11:168.
【提出问题】实验结束后,试管中的剩余固体X含有哪些成分,质量分别是多少?
【查阅资料】

铁的氧化物被还原时,是从高价铁的氧化物逐级还原成低价铁的氧化物,最后还原成金属铁.铁的部分氧化物的性质如下:
Fe3O4具有很好的磁性,能被磁铁吸引.铁的三种氧化物均不溶于水,但能溶于稀盐酸,分别发生如下反应:
Fe2O3+6HCl══2FeCl3+3H2O
Fe3O4+8HCl══2FeCl3+FeCl2+4H2O
FeO+2HCl══FeCl2+H2O
黄色的FeCl3溶液中滴入无色的KSCN溶液,溶液变为红色,该实验常用于检验FeCl3;FeCl3溶液遇单质铁发生反应:2FeCl3+Fe=3FeCl2,溶液变为浅绿色.
【猜想】固体X可能含有:①Fe ②FeO ③Fe3O4 ④Fe2O3(写化学式) ⑤C
【实施实验】
目的:确定固体X的组成.
| 步骤 | 操作 | 主要现象 | 结论 |
| I | 取部分冷却后的固体X倒在滤纸上,用磁铁充分吸引. | 部分固体被吸引到磁铁上 | 可能有Fe或Fe3O4 |
| II | 取滤纸上的剩余固体少量,放入图2所示的试管a中,通入氧气,用酒精灯加热. | 固体剧烈燃烧,b中溶液变浑浊 | 一定有C. |
| III | 另取滤纸上的剩余固体少量,放入试管中,加入足量的稀盐酸. | 无明显现象 | 一定没有FeO和Fe2O3 . |
| IV | 取步骤I磁铁上的固体少量,放入试管中,逐滴加入稀盐酸. | 产生产生气泡. | 一定有Fe |
| V | 在步骤IV所得溶液中逐滴加入KSCN溶液. | 溶液不变红色 | 一定没有Fe3O4 |
同学们讨论发现,用上述实验方法不能确定固体X中一定没有Fe3O4,理由是固体X中如果含有Fe3O4,步骤V中加盐酸后,由于铁与FeCl3反应生成FeCl2,遇KSCN溶液也不变血红色.
为确定固体X中是否含Fe3O4并测定其中各成分的质量,同学们又进行了以下实验:
| 步骤 | 操作 | 数据 |
| I | 重新取部分冷却至室温的固体X,称量其质量为m1. | m1=17.9g |
| II | 将称量好的固体X全部放入图3所示的锥形瓶中,称量整套装置及药品的质量为m2;打开分液漏斗旋塞,放入足量稀盐酸后关闭旋塞,待没有气泡产生并恢复至室温,再次称量整套装置及药品的质量为m3. | m2=317.9g m3=317.3g |
| III | 将锥形瓶中剩余的固体过滤、洗涤并干燥,称量其质量为m4. | m4=1.1g |
(1)为确定固体X中是否含Fe3O4,m1~m4中应该用到的数据有m1、m2、m3和m4.
(2)固体X各成分的质量比为11:168.
11.准确地描述实验现象是学好化学的基本素质.下列对实验现象的叙述正确的是( )
①磷在氧气中燃烧生成大量的白烟,放热.
②木炭在氧气中燃烧发出白光,放热
③硫在空气中燃烧发出明亮的蓝紫色火焰,生成有刺激性气味的气体
④细铁丝在氧气中燃烧生成四氧化三铁.
①磷在氧气中燃烧生成大量的白烟,放热.
②木炭在氧气中燃烧发出白光,放热
③硫在空气中燃烧发出明亮的蓝紫色火焰,生成有刺激性气味的气体
④细铁丝在氧气中燃烧生成四氧化三铁.
| A. | ①② | B. | ①②③ | C. | ①②④ | D. | ①②③④ |
5.下列对化学实验的描述,正确的是( )
| A. | 硫在氧气中燃烧生成一种无色无味气体 | |
| B. | 电解水时负极产生的气体能使带火星的木条复燃 | |
| C. | 点燃可燃性气体前要检验气体的纯度 | |
| D. | 用肥皂水可以把硬水转化软水 |
 据新闻报道某城镇边的一条河中惊现红色河水,被称为“红色多瑙河”,原来是某印染厂将积存的印染废水趁大雨倒入河水中,造成水体污染.
据新闻报道某城镇边的一条河中惊现红色河水,被称为“红色多瑙河”,原来是某印染厂将积存的印染废水趁大雨倒入河水中,造成水体污染.