题目内容
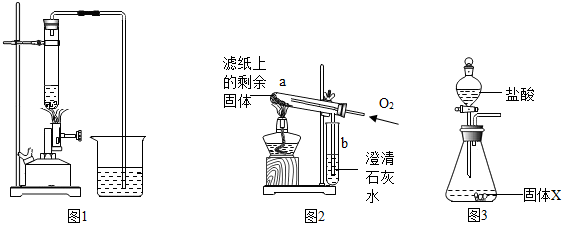
4.研究小组进行木炭还原氧化铁的探究活动.将木炭、氧化铁及试管充分烘干,并将木炭和氧化铁混合均匀、研磨.取适量上述混合物于试管中,用右图1所示的装置加热(试管竖直向上,可使加热时的热量尽少散失).【提出问题】实验结束后,试管中的剩余固体X含有哪些成分,质量分别是多少?
【查阅资料】
铁的氧化物被还原时,是从高价铁的氧化物逐级还原成低价铁的氧化物,最后还原成金属铁.铁的部分氧化物的性质如下:
Fe3O4具有很好的磁性,能被磁铁吸引.铁的三种氧化物均不溶于水,但能溶于稀盐酸,分别发生如下反应:
Fe2O3+6HCl══2FeCl3+3H2O
Fe3O4+8HCl══2FeCl3+FeCl2+4H2O
FeO+2HCl══FeCl2+H2O
黄色的FeCl3溶液中滴入无色的KSCN溶液,溶液变为红色,该实验常用于检验FeCl3;FeCl3溶液遇单质铁发生反应:2FeCl3+Fe=3FeCl2,溶液变为浅绿色.
【猜想】固体X可能含有:①Fe ②FeO ③Fe3O4 ④Fe2O3(写化学式) ⑤C
【实施实验】
目的:确定固体X的组成.
| 步骤 | 操作 | 主要现象 | 结论 |
| I | 取部分冷却后的固体X倒在滤纸上,用磁铁充分吸引. | 部分固体被吸引到磁铁上 | 可能有Fe或Fe3O4 |
| II | 取滤纸上的剩余固体少量,放入图2所示的试管a中,通入氧气,用酒精灯加热. | 固体剧烈燃烧,b中溶液变浑浊 | 一定有C. |
| III | 另取滤纸上的剩余固体少量,放入试管中,加入足量的稀盐酸. | 无明显现象 | 一定没有FeO和Fe2O3 . |
| IV | 取步骤I磁铁上的固体少量,放入试管中,逐滴加入稀盐酸. | 产生产生气泡. | 一定有Fe |
| V | 在步骤IV所得溶液中逐滴加入KSCN溶液. | 溶液不变红色 | 一定没有Fe3O4 |
同学们讨论发现,用上述实验方法不能确定固体X中一定没有Fe3O4,理由是固体X中如果含有Fe3O4,步骤V中加盐酸后,由于铁与FeCl3反应生成FeCl2,遇KSCN溶液也不变血红色.
为确定固体X中是否含Fe3O4并测定其中各成分的质量,同学们又进行了以下实验:
| 步骤 | 操作 | 数据 |
| I | 重新取部分冷却至室温的固体X,称量其质量为m1. | m1=17.9g |
| II | 将称量好的固体X全部放入图3所示的锥形瓶中,称量整套装置及药品的质量为m2;打开分液漏斗旋塞,放入足量稀盐酸后关闭旋塞,待没有气泡产生并恢复至室温,再次称量整套装置及药品的质量为m3. | m2=317.9g m3=317.3g |
| III | 将锥形瓶中剩余的固体过滤、洗涤并干燥,称量其质量为m4. | m4=1.1g |
(1)为确定固体X中是否含Fe3O4,m1~m4中应该用到的数据有m1、m2、m3和m4.
(2)固体X各成分的质量比为11:168.
分析 【猜想】根据氧化铁有可能剩余进行分析;
【实施实验】根据氧化亚铁和氧化铁能和盐酸反应,铁和盐酸反应生成氢气以及铁离子的检验,黄色的FeCl3溶液中滴入无色的KSCN溶液,溶液变为红色进行分析;
【反思改进】根据铁离子和铁反应会生成亚铁离子进行分析;
【获得结论】(1)根据铁和盐酸反应会生成氯化亚铁和氢气,依据m2、m3的质量差可以求出氢气的质量,进而求出铁的质量,m4的质量是碳的质量,通过铁和碳的质量和与m1比较确定样品中是否含有四氧化三铁;
(2)根据碳不会与盐酸反应,确定m4的质量碳的质量,通过氢气的质量可以求出铁的质量.
解答 解:【猜想】通过分析可知,氧化铁可能有剩余,所以猜想④是Fe2O3;
【实验实施】氧化亚铁和氧化铁能和盐酸反应,铁和盐酸反应生成氢气以及铁离子的检验,黄色的FeCl3溶液中滴入无色的KSCN溶液,溶液变为红色,所以
| 步骤 | 操作 | 主要现象 | 结论 |
| Ⅰ | 取部分冷却后的固体X倒在滤纸上,用磁铁充分吸引. | 部分固体被吸引到磁铁上 | 可能有Fe或Fe3O4 |
| Ⅱ | 取滤纸上的剩余固体少量,放入图2所示的试管a中,通入氧气,用酒精灯加热. | 固体剧烈燃烧,b中溶液变浑浊 | 一定有C |
| Ⅲ | 另取滤纸上的剩余固体少量,放入试管中,加入足量的稀盐酸. | 无明显现象 | 一定没有FeO和Fe2O3 |
| Ⅳ | 取步骤I磁铁上的固体少量,放入试管中,逐滴加入稀盐酸. | 产生气泡 | 一定有Fe |
| Ⅴ | 在步骤IV所得溶液中逐滴加入KSCN溶液 | 溶液不变红色 | 一定没有Fe3O4 |
【获得结论】(1)铁和盐酸反应会生成氯化亚铁和氢气,依据m2、m3的质量差可以求出氢气的质量,进而求出铁的质量,m4的质量是碳的质量,通过铁和碳的质量和与m1比较确定样品中是否含有四氧化三铁,所以为确定固体X中是否含Fe3O4,m1~m4中应该用到的数据有m1、m2、m3和m4;
(2)碳不会与盐酸反应,确定m4的质量碳的质量,所以反应后固体X中含有碳的质量为1.1g,
根据质量守恒定律可知,生成氢气的质量为:317.9g-371.3g=0.6g
设固体X中铁的质量为x,
Fe+2HCl=FeCl2+H2↑
56 2
x 0.6g
$\frac{56}{2}=\frac{x}{0.6g}$
x=16.8g
碳和铁的质量之和是:16.8g+1.1g=17.9g,所以固体X中不含四氧化三铁,成分是碳和铁,质量比为:1.1g:16.8g=11:168.
故答案为:
【猜想】④Fe2O3;
【实验实施】III.FeO和Fe2O3,IV.气泡,V.KSCN溶液;
【反思改进】固体X中如果含有Fe3O4,步骤V中加盐酸后,由于铁与FeCl3反应生成FeCl2,遇KSCN溶液也不变血红色;
【获得结论】(1)m1、m2、m3和m4;
(2)11:168.
点评 在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中所给的资料进行解答,要学会对问题进行分解.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
12.下列实验操作正确的是( )
| A. |  倾倒液体 | B. |  称量固体 | ||
| C. |  过滤 | D. |  检查装置的气密性 |
19.下列实验操作能达到实验目的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 除去混入氧气中的氮气 | 通过炽热的铜网 |
| B | 检验二氧化碳中含有少量的一氧化碳 | 点燃 |
| C | 除去木炭粉中的氧化铜 | 在空气中灼烧 |
| D | 除去FeSO4溶液中的CuSO4 | 加入足量铁粉,过滤 |
| A. | A | B. | B | C. | C | D. | D |
9.我国灿烂的文化历史悠久,源远流长.下列名句中,一定包含有化学变化的是( )
| A. | 落霞与孤鹜齐飞,秋水共长天一色 | |
| B. | 春蚕到死丝方尽,蜡炬成灰泪始干 | |
| C. | 只要功夫深,铁杵磨成针 | |
| D. | 不积跬步,无以至千里;不积小流,无以成江海 |
16.打雷放电时,空气中有极少量的氧气会转变成臭氧,少量的臭氧可以杀菌消毒,使空气清新.这个变化可表示为:氧气$\stackrel{放电}{→}$臭氧.下列说法中正确的是( )
| A. | 这是分解反应 | B. | 这是物理变化 | C. | 这是化学变化 | D. | 这是化合反应 |

