题目内容
12.如图1,①-⑥是初中阶段产生氧气的六条途径.
Ⅰ、A为纯净物,常温下为液态,写出途径①的化学方程式2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑
Ⅱ、工业上可通过途径②来生产大量氧气,途径②是物理变化过程.(填“物理变化”或“化学变化”)
Ⅲ、自然界可通过途径③来提供氧气,途径③是光合作用.
Ⅳ、④⑤⑥是实验室制取氧气的途径.其中D、E为固体纯净物,F为液体.
D通过途径④反应生成的一种生成物可作为途径⑤、⑥反应的催化剂.
(1)途径⑥反应的化学方程式是2H2O2 $\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,利用该反应选择的发生和收集装置是bc或bd(填标号),仪器f是长颈漏斗,它的优点为可以随时添加液体药品.
(2)林同学称取一定质量高锰酸钾,将温度控制在250℃加热制O2,该方法符合途径④(填①-⑥的数字). 反应的化学方程式为2KMnO4 $\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
实验结束时,林同学发现在用高锰酸钾制取氧气的实验中,收集到的O2大于理论产量,针对这一现象,同学们在老师的指导下进行了如下探究:
【提出猜想】依据质量守恒定律,他们做出如下猜想:
猜想Ⅰ:反应生成的MnO2分解放出O2
猜想Ⅱ:反应生成的K2Mn04分解放出O2
【实验验证】同学们分为两组,分别进行以下实验:
①第一组同学取一定质量的Mn02,在250℃条件下加热一段时间,冷却后测得Mn02的质量不变.则猜想Ⅰ错误.
②第二组同学取一定质量的K2Mn04在250℃条件下加热,固体质量减轻(填“减轻”或“增重”),得出了猜想Ⅱ正确的结论.
【拓展延伸】实验发现,K2MnO4受热只能部分分解,经分析可能是K2MnO4分解的生成物K2O对其分解产生影响.为验证此结论,设计如下实验方案:
①分别取K2MnO4固体于两支试管中,一支试管中加入K2O,一支试管中不加K2O.
②加热,用相同规格的集气瓶,用排水法分别收集一瓶气体.
③比较所用的时间长短,以确定锰酸钾的分解是否与氧化钾有关系.
该过程中还必须控制相同的变量是锰酸钾固体的质量和加热的温度.
分析 Ⅰ、根据A为纯净物,常温下为液态,可知A是水,电解水得到氢气和氧气写出反应的方程式;
Ⅱ、根据工业制取氧气的方法是分离液态空气法分析变化;
Ⅲ、根据自然界中植物的光合作用可以产生氧气回答;
Ⅳ、根据④⑤⑥是实验室制取氧气的途径.其中D、E为固体纯净物,F为液体,D通过途径④反应生成的一种生成物可作为途径⑤、⑥反应的催化剂,因此可知D是高锰酸钾,则E是氯酸钾,F是过氧化氢溶液,结合反应原理及发生装置、收集方法选择的依据进行回答;
【实验验证】①根据现象得出结论;②根据结论分析现象;
【拓展延伸】根据控制变量法的思想分析变量及不变的量.
解答 解:Ⅰ、A为纯净物,常温下为液态,可知A是水,电解水得到氢气和氧气,故反应的方程式为:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;
Ⅱ、工业制取氧气的方法是分离液态空气法,是利用各成分的沸点不同进行分离,因此属于物理变化;故填:物理变化;
Ⅲ、自然界中植物的光合作用可以产生氧气,故填:光合作用;
Ⅳ、④⑤⑥是实验室制取氧气的途径.其中D、E为固体纯净物,F为液体,D通过途径④反应生成的一种生成物可作为途径⑤、⑥反应的催化剂,因此可知D是高锰酸钾,则E是氯酸钾,F是过氧化氢溶液,因此:
(1)途径⑥是过氧化氢溶液在二氧化锰的作用下分解产生水和氧气,反应的方程式为:2H2O2 $\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑; 反应物是固体和液体混合在常温下反应,因此发生装置为b,氧气不易溶于水,密度比空气大,因此采用向上排空气法或排水法收集,因此组合为bc或bd;仪器f是长颈漏斗,可以随时添加液体药品;
故答案为:2H2O2 $\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑; bc或bd; 长颈漏斗; 可以随时添加液体药品;
(2)D是高锰酸钾,通过途径④完成,高锰酸钾加热产生锰酸钾、二氧化锰和氧气,反应的方程式为:2KMnO4 $\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
故答案为:④; 2KMnO4 $\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
【实验验证】①第一组同学取一定质量的Mn02,在250℃条件下加热一段时间,冷却后测得Mn02的质量不变,说明二氧化锰不能分解产生氧气,因此猜想
Ⅰ错误;
②猜想Ⅱ结论正确,说明锰酸钾能够分解产生氧气,因此质量会减轻;
故答案为:①Ⅰ;②减轻;
【拓展延伸】为了保证实验的客观性收集相同体积的氧气,需要控制锰酸钾固体的质量和加热的温度,故答案为:锰酸钾固体的质量和加热的温度.
点评 本题是综合性较强的一道关于氧气的制取题,难度不大,依据相关的信息结合已有的知识进行分析,正确写出反应的方程式等解题的关键.

 阅读快车系列答案
阅读快车系列答案| 实验次数 | 稀盐酸用量(g) | 生成二氧化碳的质量(g) |
| 1 | 10 | 1.1 |
| 2 | 10 | 2.2 |
| 3 | 10 | 3.3 |
| 4 | 10 | 4.4 |
| 5 | 10 | 4.4 |
(1)在第四次实验中,碳酸钠完全反应.
(2)求所取样品中碳酸钠的质量分数(计算结果保留一位小数).
| A. | 原子不显电性,所以构成原子的粒子也不显电性 | |
| B. | 化学变化能放出热量,能放出热量的变化一定是化学变化 | |
| C. | 化合物是由不同元素组成的纯净物,所以只含一种元素的物质一定不是化合物 | |
| D. | CO和CO2的元素组成相同,所以它们的性质也完全相同 |
| A. | 铁丝在空气中燃烧火星四射,生成黑色的四氧化三铁 | |
| B. | 氢氧化钠固体不能放在纸上、也不能直接放在天平的托盘上称量,可放在烧杯中称量 | |
| C. | 稀释浓硫酸:将水沿烧杯壁慢慢倒入盛有浓硫酸的烧杯中,并用玻璃棒不断搅拌 | |
| D. | 棉线和羊毛线灼烧时,都有烧焦羽毛气味 |

 ”所代表的物质与单质铁发生化合反应的化学方程式为:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4,能观察到的现象是剧烈燃烧,火星四射,生成黑色固体.
”所代表的物质与单质铁发生化合反应的化学方程式为:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4,能观察到的现象是剧烈燃烧,火星四射,生成黑色固体.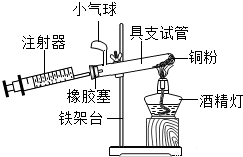 为测定空气中氧气的含量,小华同学打算设计如下方案:选用实际容积为50mL的具支试管作反应容器,将过量的铜粉放入试管,用橡皮塞塞紧具支试管,通过导管与实际容积为60mL且润滑性很好的针筒注射器组成如图的实验装置.请回答下列问题:
为测定空气中氧气的含量,小华同学打算设计如下方案:选用实际容积为50mL的具支试管作反应容器,将过量的铜粉放入试管,用橡皮塞塞紧具支试管,通过导管与实际容积为60mL且润滑性很好的针筒注射器组成如图的实验装置.请回答下列问题: 太阳能路灯是利用太阳能进行照明的装置,被越来越广泛地运用.太阳能路灯由太阳能电池板、蓄电池、LED路灯灯头、灯柱、微电脑控制器这五大部分组成.
太阳能路灯是利用太阳能进行照明的装置,被越来越广泛地运用.太阳能路灯由太阳能电池板、蓄电池、LED路灯灯头、灯柱、微电脑控制器这五大部分组成.