题目内容
5.下列物质露置于空气中,一段时间后,质量增加的是( )| A. | 浓硫酸 | B. | 双氧水 | C. | 浓盐酸 | D. | 烧碱 |
分析 根据常见物质的物理和化学性质依次分析即可,大浓硫酸具有吸水性而使质量增加,双氧水在空气中会分解出氧气,浓盐酸具有挥发性,挥发出氯化氢气体,质量也减少,氢氧化钠固体在空气中会潮解并与二氧化碳反应,质量会增加.
解答 解:A、浓硫酸具有吸水性而使质量增加,故对;
B、双氧水在空气中会分解出氧气,质量减小,故错;
C、浓盐酸具有挥发性,挥发出氯化氢气体,质量减小,故错;
D、烧碱固体在空气中会潮解并与二氧化碳反应,质量会增加,故对.
故选:AD.
点评 此题是对常见物质性质的考查,解题的重点是对四种物质在空气中的变化情况的了解,属常规性物质基础知识考查题.

练习册系列答案
相关题目
15.下列化学方程式中,书写正确的是( )
| A. | 2H2O→2H2↑+O2↑ | B. | H2SO4+NaOH→NaSO4+H2O | ||
| C. | Fe+HCl→FeCl2+H2↑ | D. | Ca(HCO3)2$\stackrel{△}{→}$CaCO3↓+CO2↑+H2O |
16.碳酸钠和碳酸氢钠是生活中常见的两种白色固体.同学们对鉴别这两种物质非常感兴趣,进行如下探究.
【查阅资料】
1.碳酸钠和碳酸氢钠在不同温度下的溶解度
2.碳酸钠和碳酸氢钠化学性质(部分)的比较
【设计方案并实施】
 【实验反思】
【实验反思】
通过上述实验,我们了解依据物质的性质设计并进行对比实验,能帮助我们更好地理解和掌握相关物理的性质.
【查阅资料】
1.碳酸钠和碳酸氢钠在不同温度下的溶解度
| 10℃ | 20℃ | 30℃ | 40℃ | |
| Na2CO3 | 12.5 g | 21.5g | 39.7g | 49.0g |
| NaHCO3 | 8.1g | 9.6g | 11.lg | I2.7g |
| 性质 | Na2CO3 | NaHCO3 | 性质比较 |
| 溶液的酸碱性 | 碱性 | 碱性 | 相铜条件下,Na2C03溶液的碱性更强 |
| 热稳定性 | 稳定 | 不稳定 | NaHCO3受热分解生成Na2C03、C02 和H20 |
| 与盐酸反应 | 反应 | 反应 | 均产生CO2,但NaHCO3与盐酸的反应更加剧烈 |
| 实验方案 | 实验现象及结论 1 |
| 方案一:20℃时,在100 g水中加入11 g该白色固体,充分溶解 | 若有白色固体剩余,样品为碳酸氢钠; 否则为碳酸钠. |
| 方案二:分别将两种待测固体溶于水制成5%的溶液,用玻璃棒分别蘸取少量待测液于pH试纸上,静置,观察现象 | pH值大的为碳酸钠溶液,pH值小的为碳酸氢钠溶液. |
| 方案三:分别取少量固体于試管中加热,将产生的气体通入澄清的石灰水中. | 若石灰水变浑浊,样品为碳酸氢钠,否则为碳酸钠. |
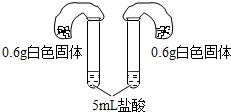
| 方案四:如阁所示,分别将气球中的白色固体全部且同时倒入装有盐酸的试管中,观察现象. | 气球胀大速度快且大的,原固体为碳酸氢钠,否则为碳酸钠 |
 【实验反思】
【实验反思】通过上述实验,我们了解依据物质的性质设计并进行对比实验,能帮助我们更好地理解和掌握相关物理的性质.
13.化学用语是学习化学的工具,下列化学符号中的数字表示的意义不正确的( )
| A. | SO2:“2”表示一个二氧化硫分子含有两个氧原子 | |
| B. | 2N:“2”表示两个氮元素 | |
| C. | $\stackrel{+2}{Mg}$O:“+2”表示氧化镁中镁元素的化合价为+2价 | |
| D. | 2NO3-:“2”表示两个硝酸银离子 |
20.如图为某化学反应的微观模拟图,其中“ ”表示氧原子,“
”表示氧原子,“ ”表示碳原子,“
”表示碳原子,“ ”表示氢原子.则下列说法不正确的是( )
”表示氢原子.则下列说法不正确的是( )

 ”表示氧原子,“
”表示氧原子,“ ”表示碳原子,“
”表示碳原子,“ ”表示氢原子.则下列说法不正确的是( )
”表示氢原子.则下列说法不正确的是( )
| A. | 化学反应前后原子的数目没有发生改变 | |
| B. | 化学反应前后分子的数目没有发生改变 | |
| C. | 反应物甲、乙两种分子的个数比为1:3 | |
| D. | 生成物丙和丁都是氧化物 |
15.下图所示的四个图象,能正确表示对应关系的是( )
| A. |  电解水 | |
| B. |  向一定质量锌粒中加入过量稀硫酸 | |
| C. |  20℃时,向一定量接近饱和的硝酸钾溶液中加入硝酸钾固体 | |
| D. |  向一定量的稀盐酸中加入足量氧化铁 |
