题目内容
17.从C、H、O、N、S、Na、Ca七种元素中选择适当元素,用化学用语填空:(1)书写化学用语:①3个钠离子3Na+;②2个铵根离子2NH4+;③一种有机酸CH3COOH; ④小苏打NaHCO3.
(2)书写化学方程式:
①中和反应:2NaOH+H2SO4=Na2SO4+2H2O(合理即可);
②鉴定二氧化碳的反应:CO2+Ca(OH)2=CaCO3↓+H2O.
分析 (1)离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字.
醋酸是一种有机酸,写出其化学式即可.
小苏打是碳酸氢钠的化学式,写出其化学式即可.
(2)首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤(写、配、注、等)进行书写即可.
解答 解:(1)①离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字.3个钠离子可表示为:3Na+.
②由离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字;故2个铵根离子表示为:2NH4+.
③醋酸是一种有机酸,其化学式为:CH3COOH.
④小苏打是碳酸氢钠的化学式,其化学式为:.
(2)①硫酸与氢氧化钠溶液反应生成硫酸钠和水,属于中和反应,反应的化学方程式为:2NaOH+H2SO4=Na2SO4+2H2O(合理即可).
②检验二氧化碳气体用澄清的石灰水,二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O.
故答案为:(1)①3Na+;②2NH4+;③CH3COOH;④NaHCO3;
(2)①2NaOH+H2SO4=Na2SO4+2H2O;②CO2+Ca(OH)2=CaCO3↓+H2O.
点评 本题难度不大,掌握常见化学用语(化学方程式、化学式、离子符号等)的书写方法、离子符号与化合价表示方法的区别等是正确解答此类题的关键.

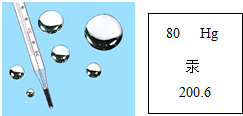 汞是银白色闪亮的重质液体,化学性质稳定,不溶于酸也不溶于碱.汞常温下即可蒸发,汞蒸发气和汞的化合物多有剧毒(慢性).汞使用的历史很悠久,用途很广泛,如图是汞在元素周期表中的相关信息,关于汞的说法正确的是( )
汞是银白色闪亮的重质液体,化学性质稳定,不溶于酸也不溶于碱.汞常温下即可蒸发,汞蒸发气和汞的化合物多有剧毒(慢性).汞使用的历史很悠久,用途很广泛,如图是汞在元素周期表中的相关信息,关于汞的说法正确的是( )| A. | 汞属于非金属元素 | |
| B. | 汞原子中质子与中子数之和为200.6 | |
| C. | 汞原子中电子数为80 | |
| D. | 汞不能与其他物质发生化学反应 |
| A. | 浓硫酸 | B. | 双氧水 | C. | 浓盐酸 | D. | 烧碱 |
(1)电石制乙炔气体(C2H2)时产生灰浆和残渣的过程如下:电石(CaC2)$\stackrel{水}{→}$灰浆$\stackrel{露置于空气}{→}$残渣
其中电石与水反应生成氢氧化钙和乙炔,写出该反应的化学方程式CaC2+2H2O=Ca(OH)2+C2H2↑.残渣中主要成分是Ca(OH)2和CaCO3.
Ⅰ.制备KClO3的流程如图:
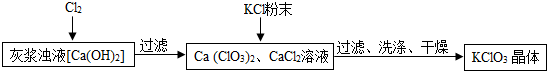
(2)向灰浆浊液中通入Cl2,得到Ca(ClO3)2、CaCl2溶液.反应中Ca(ClO3)2与CaCl2的化学计量数分别为1和5.写出此反应的化学方程式6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O.
(3)有关物质在常温下的溶解度如下:
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
(4)洗涤时,可选用下列BC洗涤剂(填字母编号).
A.KCl饱和溶液 B.冰水 C.饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如下(注:加入NH4Cl溶液的目的是溶解残渣中的难溶盐):
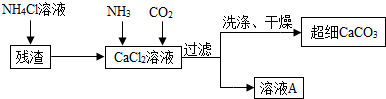
(5)向CaCl2溶液中通入两种气体,生成超细CaCO3的化学方程式CaCl2+2NH3+CO2+H2O=CaCO3↓+2NH4Cl.检验CaCO3是否洗涤干净的方法是取最后一次的洗涤液加硝酸银溶液,如有沉淀生成则没有洗干净,反之以洗干净.
(6)流程中溶液A可循环使用,其主要成分的化学式是NH4Cl.
【提出问题】溶液中的溶质是什么物质?
【作出猜想】猜想一:溶质只有氯化钙.
猜想二:溶质中有CaCl2和Ca(OH)2.
猜想三:溶液中有氯化钙和氯化氢.
【查阅资料】氯化钙溶液呈中性.
【方案设计】
| 方案 | 方法步骤 | 实验现象 | 实验结论 |
| 方案一 | 取少量烧杯内的溶液于试管中,滴入几滴无色酚酞溶液 | 酚酞不变色 | 猜想一正确 |
| 酚酞变红色 | 猜想二正确 | ||
| 方案二 | 取少量烧杯内的溶液于试管中,逐滴加入碳酸钠(或碳酸钾)溶液至过量 | 开始有气泡产生,后来有白色沉淀生成 | 猜想三正确 |
【拓展与应用】实验证明猜想三是正确的.要想使溶液中的溶质只有氯化钙,你认为应该进行的实验步骤是向烧杯中的溶液中加入碳酸钙,直到不再溶解,过滤得氯化钙溶液.
【结论】在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑可能过量的反应物.
| A. | +2 | B. | +3 | C. | +4 | D. | +5 |