题目内容
15.实验室有氧化铜和锌的混合粉末,为提炼其中的铜,取两份等质量的样品,分别按图1 和图2 两个方案进行实验:方案一:
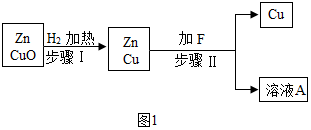
(1)写出步骤 I 中反应的化学方程式CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,该反应的反应类型为置换反应.
(2)步骤 II 中加入的溶液 F 可能是硫酸铜或稀硫酸.
方案二:
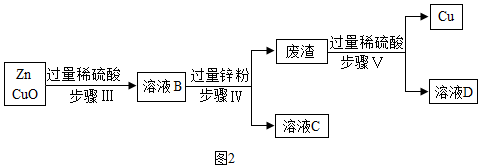
(3)步骤Ⅳ操作的名称是过滤.
(4)步骤 III 中反应的化学方程式Zn+H2SO4=H2↑+ZnSO4,H2SO4+CuO=CuSO4+H2O.
(5)上述实验体现了锌的活动性比铜强.
(6)两个方案你认为哪个更简易,并说明理由方案二,不需要加热,操作比较简单,安全.
分析 方案一:加热条件下,氧化铜和氢气反应生成铜和水;
氢气是可燃性气体,与空气或氧气混合达到一定程度时,遇明火会发生爆炸;
铜不能和稀硫酸反应,锌能和稀硫酸反应生成硫酸锌和氢气,能和硫酸铜反应生成硫酸锌和铜;
方案二:过滤能够把不溶于水的固体和液体分离开来;
氧化铜能和稀硫酸反应生成硫酸铜和水;
不同的实验方案,优缺点不同.
解答 解:方案一:
(1)步骤 I 中,加热条件下,氧化铜和氢气反应生成铜和水,反应的化学方程式为:CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,属于置换反应.
故填:CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;置换反应.
(2)因为锌能和稀硫酸反应生成硫酸锌和氢气,能和硫酸铜反应生成硫酸锌和铜,因此步骤 II 中加入的溶液 F 可能是硫酸铜或稀硫酸.
故填:硫酸铜或稀硫酸.
方案二:
(3)步骤Ⅳ操作的名称是过滤,通过过滤把溶液和铜、锌分离开来.
故填:过滤.
(4)步骤 III 中,锌能和稀硫酸反应生成硫酸锌和氢气,氧化铜能和稀硫酸反应生成硫酸铜和水,反应的化学方程式为:Zn+H2SO4=H2↑+ZnSO4,H2SO4+CuO=CuSO4+H2O.
故填:Zn+H2SO4=H2↑+ZnSO4,H2SO4+CuO=CuSO4+H2O.
(5)步骤Ⅳ中,锌能和硫酸铜反应生成硫酸锌和铜,体现了锌的活动性比铜强.
故填:强.
(6)两个方案中,方案二更简易,这是因为该方案不需要加热,操作比较简单,同时能够防止加热氧化铜和氢气时可能发生的安全事故.
故填:方案二,不需要加热,操作比较简单,安全.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

| 第1次 | 第2次 | |
| 加入稀硫酸的质量/g | 200 | 200 |
| 烧杯内物质的质量/g | 212.5 | 412.25 |
(2)下列关于上述两次反应的说法中正确的是①④;
①第1次反应后烧杯内剩余固体含有的铜和镁
②第2次反应后烧杯内剩余固体含有的铜和镁
③第1次反应稀硫酸过量
④第2次反应稀硫酸过量
(3)列式计算该铜镁合金样品中铜的质量分数(精确到小数点后一位);
(4)为配制400g上述稀硫酸,若使用98%浓硫酸配制,需水350g.
| A. | 2HCl+CuO═CuCl2+H2O | B. | 2NaOH+CO2═Na2CO3+H2O | ||
| C. | 2HCl+Cu (OH)2═CuCl2+2H2O | D. | CaO+H2O═Ca(OH)2 |

| A. | 煤 | B. | 生物质能 | C. | 核能 | D. | 可燃冰 |
 ;
;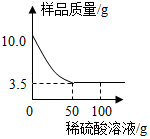 某化学兴趣小组对某铜锌合金样品进行探究实验.称取样品10.0克,再用100.0克稀硫酸溶液逐滴滴入,实验情况如图所示.求:
某化学兴趣小组对某铜锌合金样品进行探究实验.称取样品10.0克,再用100.0克稀硫酸溶液逐滴滴入,实验情况如图所示.求:
 A、B、C、D、E、F、G、H是化学实验中常见的八种物质,它们之间有如图所示的转化关系(其中E是白色沉淀,A和B可发生中和反应)
A、B、C、D、E、F、G、H是化学实验中常见的八种物质,它们之间有如图所示的转化关系(其中E是白色沉淀,A和B可发生中和反应)