题目内容
6.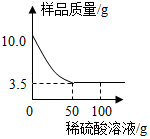 某化学兴趣小组对某铜锌合金样品进行探究实验.称取样品10.0克,再用100.0克稀硫酸溶液逐滴滴入,实验情况如图所示.求:
某化学兴趣小组对某铜锌合金样品进行探究实验.称取样品10.0克,再用100.0克稀硫酸溶液逐滴滴入,实验情况如图所示.求:(1)铜锌合金汇中,锌的质量分数是多少?
(2)恰好完全反应时所得溶液中溶质的质量分数是多少?
分析 (1)根据题意,锌与稀硫酸反应生成硫酸锌和氢气;由反应的实验情况图,完全反应后剩余固体的质量为3.5g,即铜锌合金样品中含铜的质量为3.5g;则锌的质量为10g-3.5g=6.5g;
(2)由参加反应的锌的质量,计算出生成的硫酸锌的质量和氢气的质量,进而可计算出反应后溶质的质量分数.
解答 解:(1)由反应的实验情况图,完全反应后剩余固体的质量为3.5g,即铜锌合金样品中含铜的质量为3.5g,则锌的质量为10.0g-3.5g=6.5g.
铜锌合金中,Zn的质量分数是$\frac{6.5g}{10.0g}×$100%=65%.
答:铜锌合金中,Zn的质量分数是65%;
(2)设反应生成硫酸锌的质量为x,氢气的质量为y.
Zn+H2SO4═ZnSO4+H2↑
65 161 2
6.5g x y
$\frac{65}{6.5g}=\frac{161}{x}=\frac{2}{y}$
x=16.1g,y=0.2g
恰好完全反应时所得溶液中溶质的质量分数为:$\frac{16.1g}{6.5g+50g-0.2g}$×100%≈28.6%
答:恰好反应时溶液中溶质的质量分数是28.6%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,细致地分析图表信息,确定铜的质量为3.5g的质量是正确解答本题的前提和关键.

练习册系列答案
相关题目
16.生产安全和生活安全至关重要,下列做法不符合安全要求的是( )
| A. | 进入久未开启的深井、菜窖之前做灯火试验 | |
| B. | 油锅着火,立即用水浇灭 | |
| C. | 浓硫酸粘在皮肤上,先用水冲洗,再涂上3%-5%的碳酸氢钠溶液 | |
| D. | 用燃气热水器洗澡,打开排气扇 |
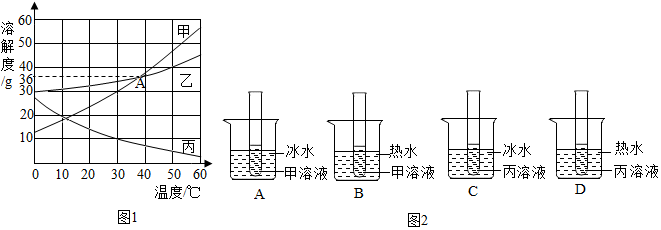
17.如图是甲、乙、丙三种固体物质的溶解度曲线,下列叙述正确的是( )
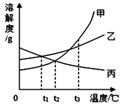

| A. | t2℃时,甲、丙两溶液中溶质的质量分数相等 | |
| B. | 甲物质中混有少量乙物质,可用降温结晶的方法提纯甲 | |
| C. | t3℃时,甲、乙、丙三种饱和溶液恒温蒸发等质量的水,则析出固体(不含水)的质量:甲>乙>丙 | |
| D. | t3℃甲乙两种饱和溶液降温到t2℃时析出固体的质量:甲>乙 |
11.欲除去CO中混有的CO2气体,最好选择下列物质中的( )
| A. | 水 | B. | 氢氧化钠溶液 | C. | 石灰水 | D. | 石蕊溶液 |
16.下列仪器不能用作反应容器的是( )
| A. |  | B. |  | C. |  | D. |  |