题目内容
7. 某同学在实验室用氯酸钾和二氧化锰的混合物制取氧气,并对反应后固体剩余物进行回收、利用,实验操作流程及数据记录如下
某同学在实验室用氯酸钾和二氧化锰的混合物制取氧气,并对反应后固体剩余物进行回收、利用,实验操作流程及数据记录如下请回答下列问题:
(1)滤液可作化肥使用,你认为它属于钾肥;
(2)该同学制得氧气的质量4.8g;
(3)计算滤液中溶质质量分数.
分析 (1)有氮元素的肥料称为氮肥,含有磷元素的肥料称为磷肥,含有钾元素的肥料称为钾肥,同时含有氮、磷、钾三种元素中的两种或两种以上的肥料称为复合肥.
(2)根据质量守恒定律可知试管内物质质量的减少量就是生成的氧气的质量,
(3)根据方程式由氧气的质量,列比例式计算出氯化钾的质量,进一步计算滤液中溶质质量分数即可.
解答 解:(1)用氯酸钾和二氧化锰制取氧气后的固体剩余物是氯化钾和二氧化锰的混合物,氯化钾易溶于水,二氧化锰不溶于水,氯化钾中含有钾元素,属于钾肥;故填:钾;
(2)根据质量守恒,减少的质量就是生成的氧气的质量,即制得氧气:15.5g-10.7g=4.8g;故填:4.8;
(3)设生成氯化钾的质量为x
2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑
149 96
x 4.8g
$\frac{149}{x}=\frac{96}{4.8g}$
x=7.45g
滤液中溶质质量分数为:$\frac{7.45g}{50g}×100%$=14.9%
答:滤液中溶质质量分数为14.9%.
点评 做本题的关键是要分析出试管内质量的减少量就是生成的氧气质量,再根据氧气质量进行进一步计算.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目
2.今年世界环境日,我国提出了“改善环境质量,推动绿色发展”的主题.下列行为不符合这一活动主题的是( )
| A. | 倡导环保低碳生活 | B. | 大力发展燃煤发电 | ||
| C. | 循环高效利用资源 | D. | 鼓励乘坐公交出行 |
12. 小金进行如图所示实验来验证质量守恒定律.在实验中用电子天平和量筒准确测量出表中m1、m2、m3、m4和V.(实验中操作正确.O2的密度为ρg/cm3)
小金进行如图所示实验来验证质量守恒定律.在实验中用电子天平和量筒准确测量出表中m1、m2、m3、m4和V.(实验中操作正确.O2的密度为ρg/cm3)
(1)装置中试管口略向下倾斜的原因是防止水蒸气冷凝回流到试管底部引起试管炸裂.
(2)根据质量守恒定律,m1、m2、m3、m4和V之间应存在的等量关系为m1+m2+m3=m4+Vρg/cm3.
(3)每次实验结束后,小金在拆卸装置时总能闻到刺激性气味.他将加热后剩余固体中的 MnO2分离并测量其质量.发现总小于加热前MnO2的质量,查阅资料后发现,一般认为加热KC1O3,和MnO2混合物的反应过程如下:
第1步:2MnO2+2KC1O3$\frac{\underline{\;\;△\;\;}}{\;}$2KMnO4+Cl2↑+O2↑;(其中Cl2有刺激性气味)
第 2 步 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑:
第3 步:K2MnO4+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+MnO2+O2↑.
写出加热后剩余固体中MnO2质量小于加热前MnO2质量的原因少量的氯气随着氧气排出,使得反应③没有发生完全.
 小金进行如图所示实验来验证质量守恒定律.在实验中用电子天平和量筒准确测量出表中m1、m2、m3、m4和V.(实验中操作正确.O2的密度为ρg/cm3)
小金进行如图所示实验来验证质量守恒定律.在实验中用电子天平和量筒准确测量出表中m1、m2、m3、m4和V.(实验中操作正确.O2的密度为ρg/cm3)| 实验序号 | 1 | 2 | … |
| m1(MnO2)/g | |||
| m2(KClO3)/g | |||
| m3(试管)/g | |||
| m4(试管+加热后剩余固体)/g | |||
| 量筒内收集气体的体积V/cm3 |
(2)根据质量守恒定律,m1、m2、m3、m4和V之间应存在的等量关系为m1+m2+m3=m4+Vρg/cm3.
(3)每次实验结束后,小金在拆卸装置时总能闻到刺激性气味.他将加热后剩余固体中的 MnO2分离并测量其质量.发现总小于加热前MnO2的质量,查阅资料后发现,一般认为加热KC1O3,和MnO2混合物的反应过程如下:
第1步:2MnO2+2KC1O3$\frac{\underline{\;\;△\;\;}}{\;}$2KMnO4+Cl2↑+O2↑;(其中Cl2有刺激性气味)
第 2 步 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑:
第3 步:K2MnO4+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+MnO2+O2↑.
写出加热后剩余固体中MnO2质量小于加热前MnO2质量的原因少量的氯气随着氧气排出,使得反应③没有发生完全.

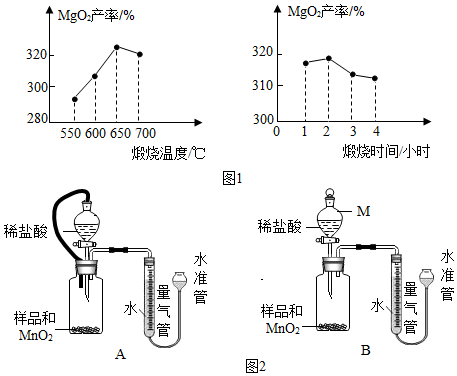
 某校举行科学实验操作考查,由学生抽签确定考察的实验内容,要求根据提供的实验器材完成相关实验.
某校举行科学实验操作考查,由学生抽签确定考察的实验内容,要求根据提供的实验器材完成相关实验.