题目内容
12. 小金进行如图所示实验来验证质量守恒定律.在实验中用电子天平和量筒准确测量出表中m1、m2、m3、m4和V.(实验中操作正确.O2的密度为ρg/cm3)
小金进行如图所示实验来验证质量守恒定律.在实验中用电子天平和量筒准确测量出表中m1、m2、m3、m4和V.(实验中操作正确.O2的密度为ρg/cm3)| 实验序号 | 1 | 2 | … |
| m1(MnO2)/g | |||
| m2(KClO3)/g | |||
| m3(试管)/g | |||
| m4(试管+加热后剩余固体)/g | |||
| 量筒内收集气体的体积V/cm3 |
(2)根据质量守恒定律,m1、m2、m3、m4和V之间应存在的等量关系为m1+m2+m3=m4+Vρg/cm3.
(3)每次实验结束后,小金在拆卸装置时总能闻到刺激性气味.他将加热后剩余固体中的 MnO2分离并测量其质量.发现总小于加热前MnO2的质量,查阅资料后发现,一般认为加热KC1O3,和MnO2混合物的反应过程如下:
第1步:2MnO2+2KC1O3$\frac{\underline{\;\;△\;\;}}{\;}$2KMnO4+Cl2↑+O2↑;(其中Cl2有刺激性气味)
第 2 步 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑:
第3 步:K2MnO4+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+MnO2+O2↑.
写出加热后剩余固体中MnO2质量小于加热前MnO2质量的原因少量的氯气随着氧气排出,使得反应③没有发生完全.
分析 (1)根据试管加热的注意事项来分析;
(2)根据质量守恒定律来分析解答;
(3)根据反应的过程来分析解答.
解答 解:(1)给试管中的固体加热时试管口略向下倾斜的原因是:防止冷凝水倒流到热的试管底部而使试管破裂;故答案为:防止水蒸气冷凝回流到试管底部引起试管炸裂;
(2)在化学反应前后,物质的总质量不变,在此反应中二氧化锰是催化剂,质量不变,氯酸钾在二氧化锰的催化作用下分解为氯化钾和氧气,则m1+m2+m3=m4+Vρg/cm3;故填:m1+m2+m3=m4+Vρg/cm3;
(3)在反应中少量的氯气随着氧气排出,使得反应③没有发生完全,所以导致剩余固体中二氧化锰的质量小于加热前二氧化锰的质量;故填:少量的氯气随着氧气排出,使得反应③没有发生完全.
点评 本题考查了实验操作的注意事项、质量守恒定律及其应用以及实验误差的分析等,难度稍大.

练习册系列答案
 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
2.下列物质的用途主要与其化学性质有关的是( )
| A. | 石墨作电极 | B. | 一氧化碳炼铁 | C. | 液氮作冷冻剂 | D. | 浓硫酸作干燥剂 |
20.钛和钛合金是重要金属材料.工业上用钛酸亚铁(FeTiO3)冶炼钛(Ti)的过程是:
①2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2TiCl4+2FeCl3+6CO ②在氩气环境中:2Mg+TiCl4$\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2
下列判断不正确的是( )
①2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2TiCl4+2FeCl3+6CO ②在氩气环境中:2Mg+TiCl4$\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2
下列判断不正确的是( )
| A. | 反应①中生成的气体对环境有污染 | |
| B. | 反应②中氯化物的总质量保持不变 | |
| C. | 反应①、②中钛元素的化合价都改变 | |
| D. | 反应②中氩气作为保护气不参加反应 |
17.分解水制氢的一种原理如图,下列关于该原理的说法正确的是( )
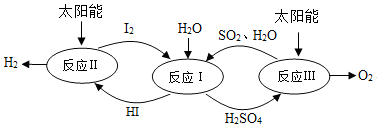

| A. | 反应过程中化合价改变的元素有H、O、S、I | |
| B. | 涉及的反应类型有分解反应和化合反应 | |
| C. | 理论上,每生成16gO2,就能得到2gH2 | |
| D. | 理论上,每分解18gH2O,就需向体系内再补充32gSO2 |
4.下列关于水的说法正确的是( )
| A. | 工业废水需要处理达标后才能排放 | |
| B. | 明矾可以使硬水转化为软水 | |
| C. | 蒸馏海水和电解水的过程中水发生的都是物理变化 | |
| D. | 蒸馏水、自来水都是纯净物 |

 某同学在实验室用氯酸钾和二氧化锰的混合物制取氧气,并对反应后固体剩余物进行回收、利用,实验操作流程及数据记录如下
某同学在实验室用氯酸钾和二氧化锰的混合物制取氧气,并对反应后固体剩余物进行回收、利用,实验操作流程及数据记录如下