题目内容
2.下列反应属于化合反应的是( )| A. | 水$\frac{\underline{\;通电\;}}{\;}$氧气+氢气 | B. | 氢气+氯气$\frac{\underline{\;点燃\;}}{\;}$氯化氢 | ||
| C. | 氧化汞$\frac{\underline{\;加热\;}}{\;}$氧气+汞 | D. | 石蜡+氧气$\frac{\underline{\;点燃\;}}{\;}$二氧化碳+水 |
分析 化合反应:两种或两种以上物质反应后生成一种物质的反应,其特点可总结为“多变一”,据此进行分析判断.
解答 解:A、水$\frac{\underline{\;通电\;}}{\;}$氧气+氢气,该反应符合“一变多”的特征,属于分解反应,故选项错误.
B、氢气+氯气$\frac{\underline{\;点燃\;}}{\;}$氯化氢,该反应符合“多变一”的特征,属于化合反应,故选项正确.
C、氧化汞$\frac{\underline{\;加热\;}}{\;}$氧气+汞,该反应符合“一变多”的特征,属于分解反应,故选项错误.
D、石蜡+氧气$\frac{\underline{\;点燃\;}}{\;}$二氧化碳+水,该反应的生成物是两种,不符合“多变一”的特征,不属于化合反应,故选项错误.
故选:B.
点评 本题难度不大,掌握化合反应的特征(“多变一”)是正确解答本题的关键.

练习册系列答案
相关题目
17.往稀硫酸中加入下列固体物质后,不能使pH显著提高的是( )
| A. | 氯化钠 | B. | 氢氧化钠 | C. | 锌粒 | D. | 氧化钙 |
13.某氢氧化钙中含有碳酸钙杂质,称取研细的该样品16.4g放入锥形瓶中,加入32.6g水,充分振荡形成悬浊液,再向锥形瓶中逐滴滴加盐酸使其充分反应至无气泡产生,测得加入盐酸的质量与锥形瓶中物质的质量关系如表所示.
(1)加入盐酸的质量在0-26g时,氢氧化钙与盐酸发生反应;
(2)反应产生二氧化碳的质量为2.2g;
(3)求样品中氢氧化钙的质量分数(写出计算过程,精确到0.1%)
| 加入盐酸的质量(g) | 0 | 26 | 38.5 |
| 锥形瓶中物质的质量(g) | 49 | 75 | 85.3 |
(2)反应产生二氧化碳的质量为2.2g;
(3)求样品中氢氧化钙的质量分数(写出计算过程,精确到0.1%)
10.高铁酸钾(K2FeO4)是一种具有氧化、吸附、凝聚、杀菌等功能的新型、高效水处理剂,它与水发生反应的化学方程式为:4K2FeO4+10H2O═4Fe(OH)3↓+8X+3O2↑,下列有关说法中错误的是( )
| A. | 高铁酸钾中铁元素的化合价是+6价 | |
| B. | 化学方程式中X的化学方程式为KOH | |
| C. | 高铁酸钾中含有单质铁 | |
| D. | 高铁酸钾可用于游泳池水的再生使用 |
7.铜镁合金具有优良的导电性,常用作飞机天线等导电材料.欲测定合金的组成,进行如下实验:取铜合金20g放入烧杯,将200g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如表.请计算:
(1)合金属于金属材料(合成材料、复合材料或金属材料)
(2)合金中铜质量为13.2克.
(3)所加稀硫酸的溶质的质量分数.(写出计算过程)
| 次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸质量/g | 50 | 50 | 50 | 50 |
| 剩余固体质量/g | 18.8 | 16.6 | 14.2 | 13.2 |
(2)合金中铜质量为13.2克.
(3)所加稀硫酸的溶质的质量分数.(写出计算过程)
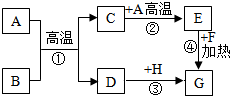 A-H是初中化学常见的物质.已知A为黑色固体物质,G为紫红色固体单质,B为红棕色粉末,F为黑色粉末,它们的转化关系如图所示,请回答:
A-H是初中化学常见的物质.已知A为黑色固体物质,G为紫红色固体单质,B为红棕色粉末,F为黑色粉末,它们的转化关系如图所示,请回答: