题目内容
20. 如图所示为某种补钙剂“钙尔奇”说明书的一部分,取1片钙尔奇,放入盛有30g盐酸的烧杯中,其中的碳酸钙跟稀盐酸恰好完全反应(其它成分与盐酸不反应),烧杯内物质的质量变为11.34g,计算:
如图所示为某种补钙剂“钙尔奇”说明书的一部分,取1片钙尔奇,放入盛有30g盐酸的烧杯中,其中的碳酸钙跟稀盐酸恰好完全反应(其它成分与盐酸不反应),烧杯内物质的质量变为11.34g,计算:(1)每片钙尔奇中含碳酸钙的质量.
(2)服用这种补钙剂,每人每天摄入钙元素的质量.
(3)所用稀盐酸中溶质的质量分数.
分析 (1)欲正确解答本题,须根据盐酸与碳酸钙反应的化学方程式,得出各物质之间的质量比,列出比例式,即可求出每片钙尔奇中含碳酸钙的质量;
(2)欲正确解答本题,须先根据元素的质量分数公式计算出碳酸钙中钙元素的质量分数,由说明书可知,使用这种补钙剂,每人每天需服用2片,则每人每天摄入钙元素的质量=每片钙尔奇中CaCO3的质量×2片×碳酸钙中钙元素的质量分数,据此答题.
(3)由(1)已计算出10g盐酸中HCl的质量,根据溶质质量分数=$\frac{溶质质量}{溶液质量}$×100%即可计算出所用盐酸中HCl的质量分数.
解答 解:(1)设每片钙尔奇中CaCO3的质量为x,10g盐酸中HCl的质量为y.
完全反应后产生的二氧化碳的质量为:2g+10g-11.34g=0.66g
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 44
x y 0.66g
$\frac{100}{x}=\frac{73}{y}=\frac{44}{0.66g}$
解之得:x=1.5g,y=1.095g.
(2)碳酸钙中钙元素的质量分数为:$\frac{40}{100}$×100%=40%
每天摄入的钙尔奇中钙元素的质量为:1.5g×2×40%=1.2g.
(3)所用盐酸中HCl的质量分数为:×100%=10.95%.
答案:
(1)每片钙尔奇中含碳酸钙的质量为1.5g;
(2)使用这种补钙剂,每人每天摄入钙元素的质量为1.2g;
(3)所用稀盐酸中溶质的质量分数为10.95%.
点评 本题主要考查学生运用化学方程式和溶质质量分数公式进行计算的能力.学生需认真分析已知条件中的数量关系,正确书写化学方程式,才能解答.

练习册系列答案
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
18.氢氧化钠是一种重要的碱,同学们对它进行了如下探究:
①探究一:判断氢氧化钠溶液与稀盐酸混合后是否恰好完全中和?
设计方案如下,请思考每个方案是否正确.
经过讨论,一致认为只有方案二是正确的,请写出该中和反应的化学方程式NaOH+HCl=NaCl+H2O;
请分析方案一错误的原因:方案一中如果反应后的溶液显酸性,酚酞试剂也不变色;
请用化学方程式表示方案三错误的原因NaCl+AgNO3=AgCl↓+NaNO3.
②探究二:一瓶久置的氢氧化钠固体的成分是什么?
请你将实验报告填写完整:(已知氯化钡溶液显中性)
通过实验,判定该久置氢氧化钠固体的成分是NaOH、Na2CO3.
①探究一:判断氢氧化钠溶液与稀盐酸混合后是否恰好完全中和?
设计方案如下,请思考每个方案是否正确.
| 实验步骤 | 实验现象预测 | 结论 | |
| 方案一 | 取少量反应后的溶液于一支试管中,并滴加几滴无色 酚酞试液,振荡 | 酚酞试液不变色 | 恰好完全中和 |
| 方案二 | 用一根洁净的玻璃棒蘸取反应后的溶液沾在pH试纸上,与标准比色卡对照 | pH=7 | 恰好完全中和 |
| 方案三 | 取少量反应后的溶液于一支试管中,并滴加稀硝酸和 硝酸银溶液 | 有白色沉淀产生 | 盐酸过量,没 有完全中和 |
请分析方案一错误的原因:方案一中如果反应后的溶液显酸性,酚酞试剂也不变色;
请用化学方程式表示方案三错误的原因NaCl+AgNO3=AgCl↓+NaNO3.
②探究二:一瓶久置的氢氧化钠固体的成分是什么?
请你将实验报告填写完整:(已知氯化钡溶液显中性)
| 实验步骤 | 实验现象 | 实验结论 |
| 步骤一:取少量固体样品于试管中,加蒸馏水完全溶解,然后滴加足量的氯化钡溶液 | 有白色沉淀产生 | 样品中含有Na2CO3 此过程中发生反应的化学方程式是Na2CO3+BaCl2=BaCO3↓+2NaCl |
| 步骤二:取步骤一试管中少量上层清液,滴加无色酚酞 | 酚酞变红色 | 样品中含有NaOH |
11. 我国有在元宵节燃放孔明灯(如图)祈福的风俗,孔明灯燃气的火焰温度可达300℃,但纸质(着火点约170℃)灯罩却没被点燃.原因是( )
我国有在元宵节燃放孔明灯(如图)祈福的风俗,孔明灯燃气的火焰温度可达300℃,但纸质(着火点约170℃)灯罩却没被点燃.原因是( )
 我国有在元宵节燃放孔明灯(如图)祈福的风俗,孔明灯燃气的火焰温度可达300℃,但纸质(着火点约170℃)灯罩却没被点燃.原因是( )
我国有在元宵节燃放孔明灯(如图)祈福的风俗,孔明灯燃气的火焰温度可达300℃,但纸质(着火点约170℃)灯罩却没被点燃.原因是( )| A. | 灯罩的材料不是可燃物 | |
| B. | 灯罩没有与氧气充分接触 | |
| C. | 风将热全吹散后纸质灯罩的着火点降低了 | |
| D. | 风将热量吹散使纸质灯罩处温度低于纸的着火点 |
8.下列自然资源的利用过程中,一定发生了化学变化的是( )
| A. | 水力发电 | B. | 石油分馏 | C. | 海水晒盐 | D. | 煤炭干馏 |
5.过氧化钠是化学中常见的一种药品,为浅黄白色颗粒,在空气中吸收水和二氧化碳,易溶于水,与水发生反应生成氢氧化钠和过氧化氢,接着过氧化氢又能分解放出氧气.
(1)请写出过氧化钠与水反应化学方程式2Na2O2+2H2O=4NaOH+O2↑
(2)请写出区别水和过氧化氢的方法分别取两种液体少许放入两支洁净的试管中,分别加入少量的二氧化锰,有大量气泡产生的液体是过氧化氢溶液,无明显现象的液体是水
(3)某同学为了证明过氧化钠与水反应生成了氢氧化钠,在反应后的溶解中滴加几滴无色酚酞溶液,发现溶液变成了红色,可是过一会儿红色消失了
【提出问题】什么原因导致溶液先变红再褪为无色
【猜想与假设】
猜想1:可能是无色酚酞溶液变质导致溶液褪色
猜想2:可能生成的过氧化氢使溶液褪色
【实验与结论】
①猜想1立即遭到其他同学的反对,因为如果是无色酚酞溶液变质,刚开始就不会先变成红色了
②为了验证猜想2,同学们设计了如表方案并验证
【讨论交流】老师提醒同学还有其他原因也会导致溶液先变红再褪为无色你认为可能还与氢氧化钠溶液浓度过大有关.(写一条即可)
【实验方案】
(1)请写出过氧化钠与水反应化学方程式2Na2O2+2H2O=4NaOH+O2↑
(2)请写出区别水和过氧化氢的方法分别取两种液体少许放入两支洁净的试管中,分别加入少量的二氧化锰,有大量气泡产生的液体是过氧化氢溶液,无明显现象的液体是水
(3)某同学为了证明过氧化钠与水反应生成了氢氧化钠,在反应后的溶解中滴加几滴无色酚酞溶液,发现溶液变成了红色,可是过一会儿红色消失了
【提出问题】什么原因导致溶液先变红再褪为无色
【猜想与假设】
猜想1:可能是无色酚酞溶液变质导致溶液褪色
猜想2:可能生成的过氧化氢使溶液褪色
【实验与结论】
①猜想1立即遭到其他同学的反对,因为如果是无色酚酞溶液变质,刚开始就不会先变成红色了
②为了验证猜想2,同学们设计了如表方案并验证
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量氢氧化钠溶液于试管中,滴加1-2滴酚酞试液,变红后往试管中滴加过氧化氢溶液观察现象观察现象 | 溶液由红色变为无色 | 不是过氧化氢使溶液颜色褪色 |
【实验方案】
| 实验步骤 | 可能出现的实验现象 | 实验结论 |
| 取少量原溶液于试管中,加入适量水,观察现象 | (1)变回红色; (2)依然无色 | (1)氢氧化钠溶液浓度过大导致溶液颜色褪去; (2)溶液颜色褪去与氢氧化钠溶液浓度无关 |
12.下列实验操作能达到实验目的是( )


| A. | ①实验可以验证质量守恒定律 | |
| B. | ②实验中可以证明金属活动性为Fe>Cu>Ag | |
| C. | ③U形管中液面变化可以鉴别氯化钠和氢氧化钠 | |
| D. | ④中根据小气球变大可以证明氢氧化钠与二氧化碳发生反应 |
9.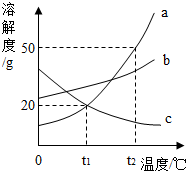 如图是a、b、c三种物质的溶解度曲线,下列分析中不正确的是( )
如图是a、b、c三种物质的溶解度曲线,下列分析中不正确的是( )
 如图是a、b、c三种物质的溶解度曲线,下列分析中不正确的是( )
如图是a、b、c三种物质的溶解度曲线,下列分析中不正确的是( )| A. | t2℃时,a、b、c三种物质的溶解度由大到小的顺序是a>b>c | |
| B. | t1℃时,将50ga物质(不含结晶水)放入100g水中充分溶解得到a的饱和溶液 | |
| C. | 将c的饱和溶液变为不饱和溶液,可采用降温的方法 | |
| D. | 将t2 时,a、b、c三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数关系是b>a=c |
 如图是a、b两种固体物质的溶解度曲线,试回答:
如图是a、b两种固体物质的溶解度曲线,试回答: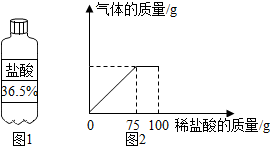 某合作学习小组的同学们为测定某石灰石的质量分数,将溶质质量分数为7.3%的稀盐酸加入10g石灰石样品中,产生气体的质量与加入稀盐酸的质量关系如图2所示(假设石灰石样品中的杂质不含钙元素,不与稀盐酸反应).
某合作学习小组的同学们为测定某石灰石的质量分数,将溶质质量分数为7.3%的稀盐酸加入10g石灰石样品中,产生气体的质量与加入稀盐酸的质量关系如图2所示(假设石灰石样品中的杂质不含钙元素,不与稀盐酸反应).