题目内容
14.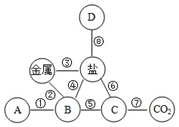 如图是小李同学构建的知识网络,其中A、B、C、D分别表示不同类别的化合物,“-”表示物质之间能够发生化学反应.请按要求回答下列问题:
如图是小李同学构建的知识网络,其中A、B、C、D分别表示不同类别的化合物,“-”表示物质之间能够发生化学反应.请按要求回答下列问题:(1)从物质类别看,“B”物质属于酸(填“氧化物”、“酸”、“碱”或“盐”).
(2)从物质组成看,一定由三种元素组成的是碱(填“氧化物”、“酸”、“碱”或“盐”).
(3)举一例用化学方程式表示反应⑥:2NaOH+CuSO4=Na2SO4+Cu(OH)2↓.
分析 (1)根据金属、盐的性质及物质之间的转化关系分析;
(2)根据“氧化物”、“酸”、“碱”、“盐”的概念,举例进行分析;
(3)根据盐和碱反应的特点分析.
解答 解:(1)由于盐的化学性质是盐与金属反应、盐与酸反应、盐与碱反应、盐与盐反应.由题目给出的信息可知:A物质属于氧化物,B物质属于酸,因为金属既能与酸反应又能与盐溶液反应,则C能与非金属氧化物反应,则C为碱,则D为盐;“B”属于酸,因为金属既能与酸反应,又能与盐溶液反应.
(2)从物质组成看,一定由三种元素组成的是碱;
(3)反应⑥是碱与盐溶液的反应,如氢氧化钠和硫酸铜溶液反应生成氢氧化铜沉淀和硫酸钠.
故答案为:
(1)酸;(2)碱;(3)2NaOH+CuSO4=Na2SO4+Cu(OH)2↓. (答案合理即可)
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.

练习册系列答案
相关题目
5.如图所示的变化只涉及物理变化的是( )
| A. |  钻木取火 | B. |  淡化海水 | C. |  改良酸性土壤 | D. |  古代炼铁 |
2.金属在日常生活、工农业生产和科学研究方面应用广泛.
(1)某实验小组为了探究锌与硫酸反应快慢的影响因素,进行了如下实验.
①用图1装置收集并测量氢气的体积,其中量筒作用是根据进入量筒中水的体积,判断生成氢气的体积,氢气应从f(填e或f或g)管通入.
②要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是①③或②④.
③下表是小兵第①组实验的详细数据.
请描述锌与硫酸反应的快慢的变化由慢到快然后逐渐减慢.
解释原因反应开始放出热量,温度升高,反应由慢到快,随着反应的进行,硫酸被消耗,硫酸溶质质量分数变小反应减慢.
(2)保险粉(化学式 Na2S2O4)在工农业生产中有广泛的用途,Na2S2O4在碱性溶液中稳定,在中性和酸性溶液中极不稳定;在 NaCl 存在下,Na2S2O4在水中溶解度显著下降.Na2S2O4制备流程如图2:
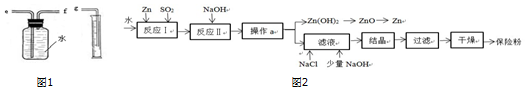
①已知反应Ⅰ的原理为:Zn+2SO2═ZnS2O4,反应Ⅱ为复分解反应,反应Ⅱ的化学方程式为2NaOH+ZnS2O4═Zn(OH)2↓+Na2S2O4.
②操作a的名称为过滤.
③滤液中含有 Na2S2O4,为使 Na2S2O4结晶析出还需要加入少量 NaOH 的原因是Na2S2O4在碱性溶液中稳定,加入NaCl的原因是降低 Na2S2O4在水中的溶解度.
④198gZn(OH)2理论上能得到Zn的质量为130g.
(1)某实验小组为了探究锌与硫酸反应快慢的影响因素,进行了如下实验.
| 实验编号 | 硫酸的质量分数 (均取20mL) | 锌的形状 (均取1g) | 氢气的体积(mL) (均收集3分钟) |
| ① | 20% | 锌粒 | 31.7 |
| ② | 20% | 锌片 | 50.9 |
| ③ | 30% | 锌粒 | 61.7 |
| ④ | 30% | 锌片 | 79.9 |
②要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是①③或②④.
③下表是小兵第①组实验的详细数据.
| 时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
解释原因反应开始放出热量,温度升高,反应由慢到快,随着反应的进行,硫酸被消耗,硫酸溶质质量分数变小反应减慢.
(2)保险粉(化学式 Na2S2O4)在工农业生产中有广泛的用途,Na2S2O4在碱性溶液中稳定,在中性和酸性溶液中极不稳定;在 NaCl 存在下,Na2S2O4在水中溶解度显著下降.Na2S2O4制备流程如图2:

①已知反应Ⅰ的原理为:Zn+2SO2═ZnS2O4,反应Ⅱ为复分解反应,反应Ⅱ的化学方程式为2NaOH+ZnS2O4═Zn(OH)2↓+Na2S2O4.
②操作a的名称为过滤.
③滤液中含有 Na2S2O4,为使 Na2S2O4结晶析出还需要加入少量 NaOH 的原因是Na2S2O4在碱性溶液中稳定,加入NaCl的原因是降低 Na2S2O4在水中的溶解度.
④198gZn(OH)2理论上能得到Zn的质量为130g.
9.下列物质分类正确的是( )
| A. | 有机物:甲烷、二氧化碳 | B. | 盐类:烧碱、纯碱 | ||
| C. | 混合物:自来水、冰水共存物 | D. | 氧化物:水、二氧化锰 |
6.对“10%的食盐溶液”含义的解释正确的是( )
| A. | 100 g水中溶解了10 g食盐 | |
| B. | 100 g食盐溶液中溶解了10 g食盐 | |
| C. | 将10 g食盐溶解于90 g水中所得的溶液 | |
| D. | 将食盐、食盐水按1:10的质量比配成的溶液 |
3.2019年9月3日,为纪念抗战胜利70周年,我国举行了盛大的阅兵仪式.阅兵仪式结束后,代表了中国人民期盼和平的愿望的7万只和平鸽和7万只气球被放飞.以下有关说法不正确的是( )
| A. | 气球在上升时,不受重力的作用 | |
| B. | 气球升空到一定高度后,会发生爆炸 | |
| C. | 制作气球的材料可能是合成材料 | |
| D. | 向气球中充气时,气球中气体的分子间隔变小 |
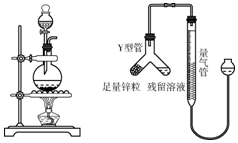
 请根据如图回答下列问题:
请根据如图回答下列问题: