题目内容
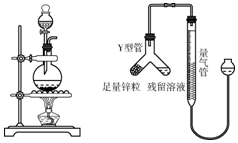
12.化学是一门以实验为基础的学科,化学所取得的丰硕成果与实验的重要作用分不开的.结合下列实验装置图回答问题: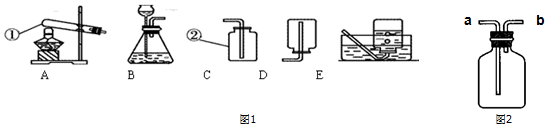
(1)写出指定仪器的名称:①试管;②集气瓶.
(2)写出实验室中用过氧化氢、高锰酸钾两种途径制取氧气的化学反应文字表达式:过氧化氢$\stackrel{二氧化锰}{→}$水+氧气、高锰酸钾$\stackrel{加热}{→}$锰酸钾+二氧化锰+氧气.
(3)实验室用高锰酸钾制取氧气时,可选用的发生装置是A(填字母代号).用排水法收集氧气完毕后,停止加热时的操作顺序是先从水槽中移出导管,然后熄灭酒精灯,以防止水倒吸进入热的试管中,造成试管破裂.如果用该装置制取气体,反应进行较长时间后,将带火星的火柴放在集气瓶口,火焰仍不复燃的原因可能是装置漏气.
(4)该同学组装了类似如图2所示的收集装置,收集氧气时用排空气法应该从a端通入,用排水法应该从b端通入.
分析 (1)熟记仪器的名称;
(2)根据化学反应的原理以及文字表达式的写法来分析;
(3)根据反应物的状态与反应条件确定制取装置、根据制取与收集的注意事项来分析解答;
(4)根据氧气的密度来分析.
解答 解:(1)仪器①是试管,②是集气瓶;故填:试管;集气瓶;
(2)过氧化氢在二氧化锰的催化作用下分解为水和氧气;高锰酸钾在加热的条件下分解为锰酸钾、二氧化锰和氧气;故填:过氧化氢$\stackrel{二氧化锰}{→}$水+氧气;高锰酸钾$\stackrel{加热}{→}$锰酸钾+二氧化锰+氧气;
(3)如果用高锰酸钾制氧气就需要加热,所以选择装置A来制取,实验结束应先从水槽中移出导管,后熄灭酒精灯,其原因是:防止水倒流,使试管炸裂;如果用该装置制取气体,反应进行较长时间后,将带火星的火柴放在集气瓶口,火焰仍不复燃的原因可能是装置漏气;故填:A;从水槽中移出导管;熄灭酒精灯;装置漏气;
(4)氧气的密度比空气大,所以用图2所示装置收集氧气时,氧气从长管进入;氧气的密度比水小,所以用图2所示装置排水法收集氧气时,氧气从短管进入;故填:a;b.
点评 本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写、气体的验满方法和注意事项等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

练习册系列答案
相关题目
2.下列过程中,没有化学变化发生的是( )
| A. | 用天然气烧水煮饭 | B. | 人吃进的食物在胃中消化 | ||
| C. | 植物进行光合作用 | D. | 将石灰石粉粹做建筑材料 |
7.下列哪一项既是光合作用的原料又是呼吸作用的产物?( )
| A. | 氧和二氧化碳 | B. | 氧和有机物 | C. | 水和二氧化碳 | D. | 水和有机物 |
1.河北水利厅2016年1月6日透露,有着“京津走廊”之称的河北廊坊市借助京津冀协同发展战略的机遇,秉承緑色发展理念,多措并举,培孕京津之间水生态环境新优势.水是我们宝贵的资源,下列做法中,符合保护水资源的做法的是( )
| A. | 水龙头坏了不停地流水,有时间再修理 | |
| B. | 农业浇灌推广使用喷灌、滴灌等技术代替大水漫灌 | |
| C. | 为保障工业用水,大力寻找水源并开凿水井 | |
| D. | 直接将生活污水排入江河中 |
2.金属在日常生活、工农业生产和科学研究方面应用广泛.
(1)某实验小组为了探究锌与硫酸反应快慢的影响因素,进行了如下实验.
①用图1装置收集并测量氢气的体积,其中量筒作用是根据进入量筒中水的体积,判断生成氢气的体积,氢气应从f(填e或f或g)管通入.
②要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是①③或②④.
③下表是小兵第①组实验的详细数据.
请描述锌与硫酸反应的快慢的变化由慢到快然后逐渐减慢.
解释原因反应开始放出热量,温度升高,反应由慢到快,随着反应的进行,硫酸被消耗,硫酸溶质质量分数变小反应减慢.
(2)保险粉(化学式 Na2S2O4)在工农业生产中有广泛的用途,Na2S2O4在碱性溶液中稳定,在中性和酸性溶液中极不稳定;在 NaCl 存在下,Na2S2O4在水中溶解度显著下降.Na2S2O4制备流程如图2:
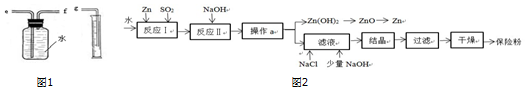
①已知反应Ⅰ的原理为:Zn+2SO2═ZnS2O4,反应Ⅱ为复分解反应,反应Ⅱ的化学方程式为2NaOH+ZnS2O4═Zn(OH)2↓+Na2S2O4.
②操作a的名称为过滤.
③滤液中含有 Na2S2O4,为使 Na2S2O4结晶析出还需要加入少量 NaOH 的原因是Na2S2O4在碱性溶液中稳定,加入NaCl的原因是降低 Na2S2O4在水中的溶解度.
④198gZn(OH)2理论上能得到Zn的质量为130g.
(1)某实验小组为了探究锌与硫酸反应快慢的影响因素,进行了如下实验.
| 实验编号 | 硫酸的质量分数 (均取20mL) | 锌的形状 (均取1g) | 氢气的体积(mL) (均收集3分钟) |
| ① | 20% | 锌粒 | 31.7 |
| ② | 20% | 锌片 | 50.9 |
| ③ | 30% | 锌粒 | 61.7 |
| ④ | 30% | 锌片 | 79.9 |
②要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是①③或②④.
③下表是小兵第①组实验的详细数据.
| 时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
解释原因反应开始放出热量,温度升高,反应由慢到快,随着反应的进行,硫酸被消耗,硫酸溶质质量分数变小反应减慢.
(2)保险粉(化学式 Na2S2O4)在工农业生产中有广泛的用途,Na2S2O4在碱性溶液中稳定,在中性和酸性溶液中极不稳定;在 NaCl 存在下,Na2S2O4在水中溶解度显著下降.Na2S2O4制备流程如图2:

①已知反应Ⅰ的原理为:Zn+2SO2═ZnS2O4,反应Ⅱ为复分解反应,反应Ⅱ的化学方程式为2NaOH+ZnS2O4═Zn(OH)2↓+Na2S2O4.
②操作a的名称为过滤.
③滤液中含有 Na2S2O4,为使 Na2S2O4结晶析出还需要加入少量 NaOH 的原因是Na2S2O4在碱性溶液中稳定,加入NaCl的原因是降低 Na2S2O4在水中的溶解度.
④198gZn(OH)2理论上能得到Zn的质量为130g.