题目内容
8.将(NH4)2SO4和Na2CO3两种溶液充分混合加热,发现有气泡产生且闻到刺激性气味.同学们对气体成分产生兴趣.【查阅】CuO和NH3加热时发生反应:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O
【猜想】猜想一:气体是CO2 猜想二:气体是NH3猜想三:气体是NH3和CO2
【讨论】(1)猜想一肯定不正确,理由是CO2无刺激性气味;
(2)因Na2CO3属于盐类但溶液呈碱(填“酸”或“碱”)性,故有NH3产生.
【探究】为确定气体成分,设计如图1装置(夹持装置未画出):
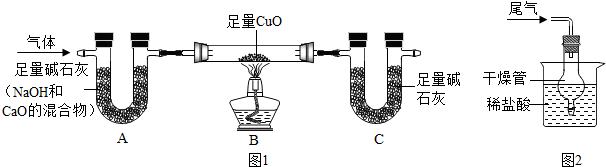
(1)实验后,取少量A中固体于试管中,加入过量的稀盐酸,观察到有气泡产生,证明其中含CO2;
(2)B中观察到黑色固体变为红色,证明含有NH3;
(3)若B装置连同固体质量减轻4.8g,则C装置增加的质量为5.4g;
【反思】
(1)实验测得装置C增加的质量大于理论值,可能的原因是装置C吸收了空气中的水蒸气和二氧化碳;
(2)氨气也是污染物,在C装置后连接图2装置,以吸收尾气中未参加反应的氨气.干燥管的作用是②(填序号).
①防止氨气逸出 ②防止液体倒吸 ③防止盐酸挥发
(3)(NH4)2SO4也是一种化肥,在使用时注意不能与碱性物质混用,如熟石灰与硫酸铵反应方程式(NH4)2SO4+Ca(OH)2=CaSO4+2H2O+2NH3↑由上述实验可推知这里的碱性物质不一定是碱类(一定或不一定).
分析 【讨论】
二氧化碳是无色、无味的气体;
碳酸钠属于盐,水溶液显碱性;
【探究】
二氧化碳能和氢氧化钠反应生成碳酸钠和水,碳酸钠能和稀盐酸反应生成氯化钠、水和二氧化碳;
根据实验现象可以判断气体中是否含有氨气;
B装置连同固体质量减轻4.8g,说明氧化铜中的4.8g氧元素和氢元素结合生成水,根据水的组成可以计算水的质量,水的质量即为则C装置增加的质量;
【反思】
C装置中的碱石灰可以吸收空气中的二氧化碳和水蒸气;
干燥管有较大的体积,可以防止液体倒吸;
根据题中的反应原理找出反应物、生成物以及反应条件,然后依据质量守恒定律书写化学方程式,
解答 解:【讨论】(1)猜想一肯定不正确,理由是CO2无刺激性气味.
故填:CO2无刺激性气味.
(2)因Na2CO3属于盐类,溶液呈碱性,故有NH3产生.
【探究】
(1)实验后,取少量A中固体,加入稀盐酸,观察到有气泡产生,说明固体中含有碳酸钠,进一步证明其中含CO2.
故填:有气泡产生.
(2)B中观察到黑色固体变为红色,证明气体中含有NH3.
故填:黑色固体变为红色.
(3)(NH4)2SO4和Na2CO3两种溶液发生反应生成硫酸钠、水、二氧化碳和氨气,反应的方程式为:(NH4)2SO4+Na2CO3═Na2SO4+H2O+CO2↑+2NH3↑.
故填:(NH4)2SO4+Na2CO3═Na2SO4+H2O+CO2↑+2NH3↑.
(4)设生成水的质量为x,
若B装置连同固体质量减轻4.8g,说明有4.8g氧元素和氢元素结合生成了水
x×$\frac{16}{18}$×100%=4.8g,
x=5.4g.
故填:5.4g.
则C装置增加的质量为 5.4g;
【反思】
(1)实验测得装置C增加的质量大于理论值,可能的原因是装置C吸收了空气中的水蒸气和二氧化碳.
故填:装置C吸收了空气中的水蒸气和二氧化碳.
(2)干燥管的作用是防止液体倒吸.
故填:②.
(3)硫酸铵和氢氧化钙反应生成硫酸钙、水和氨气,化学方程式为:(NH4)2SO4+Ca(OH)2=CaSO4+2H2O+2NH3↑,由上述实验可推知这里的碱性物质不一定是碱类.
答案:
【讨论】(1)CO2无刺激性气味;
(2)盐;碱;
【探究】
(1)有气泡产生;
(2)黑色固体变为红色;
(3)5.4g;
【反思】
(1)装置C吸收了空气中的水蒸气和二氧化碳;
(2)②
(3)(NH4)2SO4+Ca(OH)2=CaSO4+2H2O+2NH3↑;不一定.
点评 实验现象是物质之间相互作用的外在表现,因此要学会设计实验、观察实验、分析实验,为揭示物质之间相互作用的实质奠定基础.

| A. | 视黄醇属于有机高分子化合物 | |
| B. | 视黄醇的化学式中X=2 | |
| C. | 视黄醇中碳氢元素的质量比为2:3 | |
| D. | 视黄醇中氢元素的质量分数约为10.5% |
 如图所示,上瓶装的是无色的空气,下瓶装的是不与空气发生化学反应的某种红棕色气体,当抽走玻璃片后,过一会,将会发生的现象是红棕色气体逐渐向上瓶中扩散,下瓶颜色变浅,最后上下两瓶中气体的颜色一致,此实验可以说明分子是在不断运动的且分子间存在间隙.
如图所示,上瓶装的是无色的空气,下瓶装的是不与空气发生化学反应的某种红棕色气体,当抽走玻璃片后,过一会,将会发生的现象是红棕色气体逐渐向上瓶中扩散,下瓶颜色变浅,最后上下两瓶中气体的颜色一致,此实验可以说明分子是在不断运动的且分子间存在间隙.