题目内容
13.蛋白质是机体生长及修补受损组织的主要原料,人体通过食物获得的蛋白质在胃肠中与水反应,生成氨基酸,蛋氨酸(C5H11O2NS)就是其中的一种.(1)蛋氨酸中各元素的质量比C:H:O:N:S=60:11:32:14:32.
(2)蛋氨酸中氮元素的质量分数为9.4%.
分析 (1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(2)根据元素的质量分数的计算方法来分析.
解答 解:(1)根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,可得蛋氨酸(化学式为C5H11O2NS)中碳、氢、氧、氮、硫五种元素的质量比为(12×5):(1×11):(16×2):(14×1):(32×1)=60:11:32:14:32.故答案为:60:11:32:14:32;
(2)蛋氨酸(化学式为C5H11O2NS)中氮元素的质量分数=$\frac{14}{12×5+1×11+16×2+14+32}$×100%≈9.4%.故答案为:9.4%.
点评 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
相关题目
8.化学小组的同学分析某无色透明的溶液中含有三种溶质,其中可能正确的是( )
| A. | KMnO4、CuCl2、Fe2(SO4)3 | B. | HCl、AgNO3、Na2SO4 | ||
| C. | NaCl、KNO3、(NH4)2SO4 | D. | H2SO4、K2CO3、NaOH |
9.下列物质的变化过程中既发生物理变化,又发生化学变化的是( )
| A. | 石蜡燃烧 | |
| B. | 久置于空气中的浓硫酸失去了吸水性 | |
| C. | 白磷自燃 | |
| D. | 灯泡通电发光、放热 |
1.氧化镁在医药、建筑等行业应用广泛,以菱镁矿(主要成分为MgCO3,含少量FeCO3,其他杂质不溶,也不参加反应)为原料制备高纯氧化镁的实验流程如图1:

资料:①不同氢氧化物沉淀的pH范围:
②硫在常温下是一种淡黄色固体,硫的熔点约为115.2℃,沸点约为444.7℃;
③高锰酸钾溶液只吸收SO2,不吸收CO2;
④碱溶液既吸收SO2,又吸收CO2.
试回答下列问题:
(1)MgCO3与稀硫酸反应的化学方程式为MgCO3+H2SO4═MgSO4+CO2↑+H2O.
(2)加入H2O2目的是在酸性条件下将FeSO4氧化成Fe2(SO4)3,同时生成水,发生反应的化学方程式为2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O.
(3)加氨水调节溶液的pH约为4的目的是控制反应只生成氢氧化铁沉淀而不生成氢氧化镁沉淀,反应的化学方程式为Fe2(SO4)3+6NH3•H2O=2Fe(OH)3↓+3(NH4)2SO4.
(4)煅烧过程存在以下反应:
2MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$2MgO+2SO2↑+CO2↑
MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$MgO+SO2↑+CO↑
MgSO4+3C$\frac{\underline{\;800℃\;}}{\;}$MgO+S↑+3CO↑
利用如图2装置对煅烧产生的气体进行分步吸收或收集.(假设每步反应都完全进行)
①A中现象是:玻璃管壁出现黄色固体;
②B中盛放的溶液可以是d(填字母),实验现象为紫红色高锰酸钾溶液颜色褪去;
a.Ca(OH)2 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③D中收集的气体是CO(填化学式).

资料:①不同氢氧化物沉淀的pH范围:
| 氢氧化物 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 1.5 | 8.6 |
| 完全沉淀的pH | 3.2 | 11.1 |
③高锰酸钾溶液只吸收SO2,不吸收CO2;
④碱溶液既吸收SO2,又吸收CO2.
试回答下列问题:
(1)MgCO3与稀硫酸反应的化学方程式为MgCO3+H2SO4═MgSO4+CO2↑+H2O.
(2)加入H2O2目的是在酸性条件下将FeSO4氧化成Fe2(SO4)3,同时生成水,发生反应的化学方程式为2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O.
(3)加氨水调节溶液的pH约为4的目的是控制反应只生成氢氧化铁沉淀而不生成氢氧化镁沉淀,反应的化学方程式为Fe2(SO4)3+6NH3•H2O=2Fe(OH)3↓+3(NH4)2SO4.
(4)煅烧过程存在以下反应:
2MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$2MgO+2SO2↑+CO2↑
MgSO4+C$\frac{\underline{\;800℃\;}}{\;}$MgO+SO2↑+CO↑
MgSO4+3C$\frac{\underline{\;800℃\;}}{\;}$MgO+S↑+3CO↑
利用如图2装置对煅烧产生的气体进行分步吸收或收集.(假设每步反应都完全进行)
①A中现象是:玻璃管壁出现黄色固体;
②B中盛放的溶液可以是d(填字母),实验现象为紫红色高锰酸钾溶液颜色褪去;
a.Ca(OH)2 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③D中收集的气体是CO(填化学式).
8.一些食物的近似PH如表:
(1)苹果汁和葡萄汁相比较,酸性较强的是苹果汁,它能使石蕊试液变红色.
(2)人的胃液中含有盐酸,对于胃酸过多的人,空腹时最宜食用的食物是玉米.
(3)鸡蛋壳中含有CaCO3,以前因胃酸过多导致胃痛时,有人吃鸡蛋壳粉.现今,许多冶疗胃酸过多的药品的有效成分是氢氧化铝,而不是CaCO3,提出一种理由说明为什么氢氧化铝优越于碳酸钙因为CaCO3与胃酸反应产生CO2气体,会使人有胃胀的感觉,而使用Al(OH)3,则不会有这种现象.
| 食物 | 苹果 | 葡萄 | 牛奶 | 玉米 |
| PH | 2.9~3.3 | 3.5~4.5 | 6.3~6.6 | 6.8~8.0 |
(2)人的胃液中含有盐酸,对于胃酸过多的人,空腹时最宜食用的食物是玉米.
(3)鸡蛋壳中含有CaCO3,以前因胃酸过多导致胃痛时,有人吃鸡蛋壳粉.现今,许多冶疗胃酸过多的药品的有效成分是氢氧化铝,而不是CaCO3,提出一种理由说明为什么氢氧化铝优越于碳酸钙因为CaCO3与胃酸反应产生CO2气体,会使人有胃胀的感觉,而使用Al(OH)3,则不会有这种现象.
18.如图所示实验设计与对应的实验目的表述不一致的是( )
| A. | 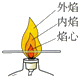 比较火焰各层温度 | B. | 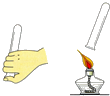 检验氢气纯度 | ||
| C. |  验证CO2的密度比空气大 | D. | 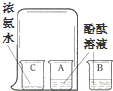 探究分子运动对温度的影响 |
5.以黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)为原料炼铜的方法分为高温炼铜和湿法炼铜两种.近年来,湿法炼铜有了新进展.科学家发现有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿氧化成硫酸盐,反应方程式如下:(4CuFeS2+2H2SO4+17O2═4CuSO4+2Fe2(SO4)3+2H2O),某工厂运用该原理生产铜和绿矾(FeSO4的晶体,含结晶水).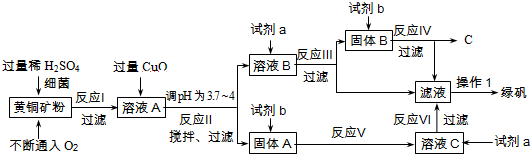
资料:①部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表:
②在溶液中,存在反应:Fe2(SO4)3+Fe═3FeSO4
回答下列问题:
(1)溶液A的成分为H2SO4、CuSO4、Fe2(SO4)3(写化学式),试剂b为稀硫酸;
(2)反应Ⅱ中加CuO调pH为3.7~4的目的是使Fe3+形成Fe(OH)3沉淀,防止生成Cu(OH)2沉淀;
(3)反应Ⅲ的化学方程式CuSO4+Fe=Cu+FeSO4;
(4)欲从溶液中获得绿矾晶体,分离操作Ⅰ应为蒸发浓缩、冷却结晶、过滤.

资料:①部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表:
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
回答下列问题:
(1)溶液A的成分为H2SO4、CuSO4、Fe2(SO4)3(写化学式),试剂b为稀硫酸;
(2)反应Ⅱ中加CuO调pH为3.7~4的目的是使Fe3+形成Fe(OH)3沉淀,防止生成Cu(OH)2沉淀;
(3)反应Ⅲ的化学方程式CuSO4+Fe=Cu+FeSO4;
(4)欲从溶液中获得绿矾晶体,分离操作Ⅰ应为蒸发浓缩、冷却结晶、过滤.
3.在反应xM+yN═mP+nQ中,下列说法正确的是( )
| A. | 若M为单质,N为化合物,则该反应一定是置换反应 | |
| B. | 数值x与y的和等于m与n的和 | |
| C. | 若该反应是复分解反应,则M、N、P、Q一定是化合物 | |
| D. | 若反应物M失氧,则该反应可能是化合反应 |