题目内容
14.18世纪70年代,瑞典化学家舍勒首先发现并制得了氯气(Cl2).氯气是一种黄绿色、密度比空气大且有毒的气体,它能与水发生化学反应生成盐酸和次氯酸(HClO).氯气也能与碱溶液发生化学反应.在实验室中,通常用二氧化锰固体与浓盐酸在加热的条件下制取氯气.现提供如图所示实验装置,试回答下列问题: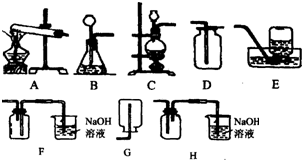
(1)实验室中制取氯气应采用的发生装置是C,收集并吸收氯气应选用的装置为H.(均填序号)
(2)上述装置的烧杯中盛有的氢氧化钠溶液的作用是用于吸收多余的氯气,防止氯气污染空气,试写出氯气和氢氧化钠溶液反应的化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O.
(3)自来水厂经常用氯气做消毒剂.目前市场上出售的某些假冒“纯净水”是用自来水灌装的,请你利用所学的化学知识加以鉴别,并写出有关的化学方程式HCl+AgNO3═AgCl↓+HNO3,NaOH+HCl=NaCl+H2O.
(4)次氯酸具有漂白性,它可以将某些有色物质氧化成无色物质.某同学用滴管将饱和氯水(氯气的水溶液)逐滴滴入含有酚酞试液的NaOH溶液中,当滴到最后一滴时,红色突然褪去.红色褪去的原因可能有两种情况(用简要的文字说明):
①酸和碱发生了中和反应,红色褪去;②次氯酸具有漂白性,也可以使红色褪去.
(5)请设计一个简单的实验,确定(4)中红色褪去的原因是①还是②?在反应后的溶液中加氢氧化钠溶液,如果红色又出现,那么原因就是酸碱中和;反之则为氯水氧化指示剂.
分析 制取装置包括加热和不需加热两种,在实验室中,通常用二氧化锰固体与浓盐酸在加热的条件下制取氯气,因此需要加热;氯气是一种黄绿色、密度比空气大且有毒的气体,氯气可以用氢氧化钠溶液吸收,因此选择H;氯气和氢氧化钠反应生成氯化钠和次氯酸钠和水,配平即可;假冒“纯净水”中有盐酸和次氯酸,可以用硝酸银溶液检验,盐酸和硝酸银反应生成氯化银白色沉淀和硝酸;还可以用滴有酚酞试液的氢氧化钠溶液检验,红色变无色;红色褪去的原因可能有两种情况:酸和碱发生了中和反应,红色褪去;次氯酸具有漂白性,也可以使红色褪去;简单的实验是:在反应后的溶液中加氢氧化钠溶液,如果红色又出现,那么原因就是酸碱中和;反之则为氯水氧化指示剂.
解答 解:(1)在实验室中,通常用二氧化锰固体与浓盐酸在加热的条件下制取氯气,因此需要加热;氯气是一种黄绿色、密度比空气大且有毒的气体,氯气可以用氢氧化钠溶液吸收,因此选择H;故答案为:C;H;
(2)氯气和氢氧化钠反应生成氯化钠和次氯酸钠和水,配平即可,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(3)假冒“纯净水”中有盐酸和次氯酸,可以用硝酸银溶液检验,盐酸和硝酸银反应生成氯化银白色沉淀和硝酸;还可以用滴有酚酞试液的氢氧化钠溶液检验,红色变无色;故答案为:HCl+AgNO3═AgCl↓+HNO3;NaOH+HCl=NaCl+H2O;
(4)红色褪去的原因可能有两种情况:酸和碱发生了中和反应,红色褪去;次氯酸具有漂白性,也可以使红色褪去;故答案为:酸和碱发生了中和反应,红色褪去;次氯酸具有漂白性,也可以使红色褪去;
(5)简单的实验是:在反应后的溶液中加氢氧化钠溶液,如果红色又出现,那么原因就是酸碱中和;反之则为氯水氧化指示剂;故答案为:在反应后的溶液中加氢氧化钠溶液,如果红色又出现,那么原因就是酸碱中和;反之则为氯水氧化指示剂;
点评 本考点主要考查了气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和实验设计等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

| 序号 | 加入稀盐酸的质量/g | 剩余固体的质量/g |
| 第1次 | 20 | 16 |
| 第2次 | 20 | 12 |
| 第3次 | 20 | 8.5 |
| 第4次 | 20 | n |
(2)样品中铜的质量分数是57.5%.
(3)求盐酸中溶质的质量分数.
| 实验设计 | 结论 | 你的评价(是否可行,简述理由) | |
| 方案一 | 取5mL试液放入试管中,滴加几滴硫酸铜溶液后,振荡,有沉淀产生. | 含有碳酸钠 | |
| 方案二 | 取5mL试液放入试管中,滴加几滴稀硫酸后,振荡,无气泡产生. | 不含有碳酸钠 | |
| 方案三 | 取5mL试液放入试管中,滴加几滴氯化钡后,振荡,有白色沉淀产生. | 含有碳酸钠 |
| A. | 它是由氧化铜、水和二氧化碳组成 | |
| B. | 它一定含有C、H、Cu元素,不含有O元素 | |
| C. | 它一定含有C、Cu元素,可能含有H、O元素 | |
| D. | 它由C、H、O、Cu四种元素组成 |
| 加入稀盐酸的次序 | 1 | 2 | 3 | 4 |
| 加入稀盐酸的质量/g | 10 | 10 | 10 | 10 |
| 剩余固体的质量/g | 4.0 | m | 0.6 | 0.6 |
(2)m=2.0;
(3)样品中CaCO3的质量分数;
(4)所用稀盐酸的质量分数.